(*A*) Abstract, or Summary, of this publication to be found at the end of this list (Paragraph C.); (*A*)-fig in addition with selected figures.
(*Z*) Zusammenfassung (Deutsch) am Ende der Liste (Abschnitt D.); (*Z*)-abb zusätzlich mit ausgewählten Abbildungen.
A. Liste nach Publikationsdatum - List by sequence of publication
B. Liste nach Arten und Themen - List by species, and by subjects
B.1 Raubwürger - Great Grey Shrike Lanius excubitor
B.2 Feldlerche - Skylark Alauda arvensis
B.3 Grünspecht - Green Woodpecker Picus viridis
B.4 Heidelerche - Woodlark Lullula arborea
B.5 Schleiereule - Barn Owl Tyto alba
B.6 Steinschmätzer - Northern Wheatear Oenanthe oenanthe
B.7 Wachtel - Eurasian Quail Coturnix coturnix
B.8 Wendehals - Wryneck Jynx torquilla
B.9 Wiedehopf - Hoopoe Upupa epops
B.10 Ziegenmelker - Nightjar Caprimulgus europaeus
B.11 Steinkauz - Little Owl Athene noctua
B.12 Ökosysteme - Ecosystems
B.13 Naturschutz - Nature Conservation
B.14 Zeichnungsmuster und optische Signale - Optical signals
B.15 Evolution der (Grau-) Würger - Evolution of Shrikes
C. Abstracts and Summaries
D. Zusammenfassungen (in Deutsch)
E. Anhang - Appendix
E.1 Register - Stichwort-Verzeichnis (in Deutsch) zu: Ökologie der Vögel 16 (1), 1994: 1-581.
E.2 Index (in English) for: Ökologie der Vögel (Ecology of Birds) 16 (1), 1994: 1-581.
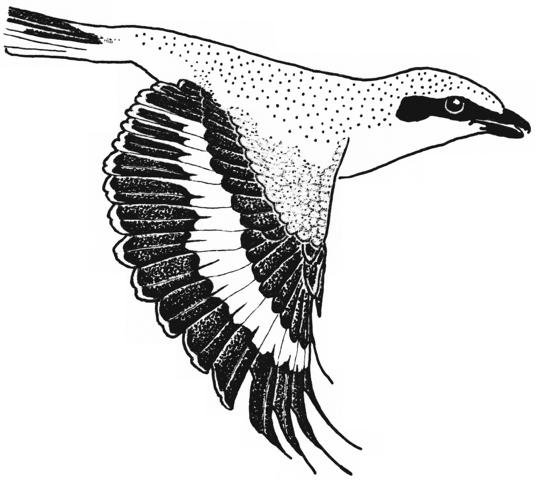
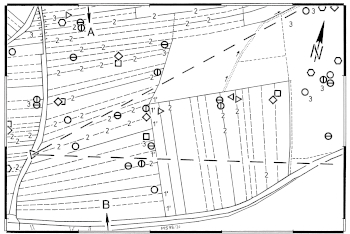
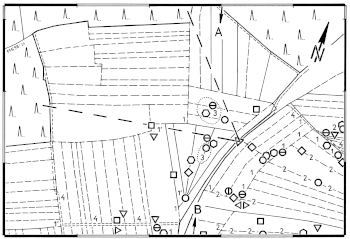
Abb.21, Abb.22 (Teile) Häufung von Feldlerchen-Brutplätzen (Revierzentren, 1995-2000, Symbole) nahe an traditionellen Kleinstrukturen des Ackerlandes ('Störstellen mit Kümmerwuchs', Zahlen). Karten aus Schön 2000: Abb.21, Abb.22, ergänzt mit zusätzlichen Daten (für Einzelheiten, s. (*Z32*)-abb ). - Fig.21, Fig.22 (parts) Clumping of breeding sites of the Skylark (territory centers, 1995-2000, symbols) near traditional micro-structures in arable land ('places with stunted growth', numbers). Maps from Schön 2000: Fig.21, Fig.22, supplemented with additional data (for details, see (*A32*)-fig ).

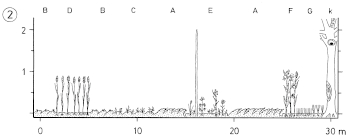
Abb.23 (Teile) 'Kleinacker-Bewirtschaftung' nach traditionellem Vorbild der Hackfrucht-'Feldgärten' (links): durch häufiges Umackern von wechselnden Streifen mit bloßem Boden (rechts). Günstiger Nahrungssuchplatz für Würger, Steinkauz, Wiedehopf (aus Schön 2000; für Einzelheiten, s. (*Z32*)-abb : Abb.23). - Fig.23 (parts) Mimicking of traditional multi-crop cultivation in patches of arable land (left): by frequent ploughing of alternating strips with uncovered ground (right). Rewarding foraging sites for Shrikes, Little Owl, Hoopoe (from Schön 2000; for details, see (*A32*)-fig : Fig.23).

Some observations on the breeding association of Fieldfares (Turdus pilaris) and Great Grey Shrikes (Lanius excubitor) are reported. A colony of Fieldfares (of at least 27 adults, i.e. 13 - 14 breeding pairs) settled in close vicinity to a nest of the Great Grey Shrike. Two of the thrushes' nests were found in a distance of only about 10 m from the shrike's nest. For unknown reasons, the shrikes abandoned their nest in a completed and fully intact state. These two freshly started nests of Fieldfares were not completed and deserted too. Thereafter, the Fieldfares were only observed in a distance of at least 50 m from the shrike's nest. Supposedly, the Fieldfares deserted their nests in close vicinity to the Great Grey Shrike's nest because the nesting pair of shrikes disappeared. Thus it might be concluded that the Fieldfares actively searched for the breeding association with the Great Grey Shrike (and not vice versa).
1. The Great Grey Shrike Lanius excubitor shows different grades of attack- and flight-behaviour in response to different species of birds and mammals. The behaviour changes regularly during the course of the year (Fig.1 - Fig.12).
2. The annual cycle of Lanius excubitor is briefly described.
3. The shrike's adversaries and neighbours can be grouped in six classes: The first includes species that are dangerous to adults of Lanius excubitor (goshawk, sparrowhak, peregrine, hobby); the second ones that threaten young and eggs (buzzard, kestrel, corvids); a third that is of similar size to L. excubitor and of little consequences (thrushes, starling); a fourth, small birds, which constitute prey; a fifth, which are food competitors (other shrikes); and, sixth, mammals which may or may not threaten nests and offspring.
4. The interspecific behaviour of Lanius excubitor seems to be appropriately adjusted (Table 1). The attack behaviour elicited by members of the first class is restricted to a few reactions, though flight-behaviour is extremely variable. The second class of predators elicits variable attack-behaviour, while the flight-behaviour is less variable. As to the third group, the reactions are simple, serving chiefly as claims for a position or attack. The species that are smaller than Lanius excubitor elicit still simpler reactions. Anti-predator behaviour changes into territorial or hunting behaviour, with diminishing size and dangerousness of the other species. These specific and different reactions displayed towards very similar species makes probable that Lanius excubitor can distinguish at least some of these species.
5. Seasonally, there are two peaks in the attack-behaviour towards all species (Fig.1 - Fig.12): one during the breeding season around fledgling time of the young of Lanius excubitor, and the other one in autumn, during pairing. Flight-behaviour and neutral reactions prevail the rest of the year. Different species are attacked over periods of different length according to the significance of the species for Lanius excubitor.
6. The behaviour is more variable yet towards certain other species. Magpies Pica pica and Jays Garrulus glandarius regularly steal the stored prey of Lanius excubitor and have probably developped different techniques for this purpose. As a counter-adaptation, Lanius excubitor has evolved a defence-behaviour. Fieldfares Turdus pilaris form breeding communities with L. excubitor, the reason for this, possibly, being mutual advantages, but especially to the Fieldfare.
7. The adaptive value of bird-hunting (Fig.13) and the mobbing of Lanius excubitor by small birds are discussed. Mobbing seems to be influenced by learning.
8. The ontogeny of interspecific behaviour of Lanius excubitor is described.
9. There is a great amount of variation in the attack-behaviour and flight-behaviour between different individuals of Lanius excubitor, and different factors are responsible for this: the change in the roles taken by male and female during the breeding cycle, the influence of dominance within the pair, effects of habituation, diurnal variation, dependence on weather, and variations in the hierarchy of different behavioural traits under different conditions.
1. Habitat demands: In Central Europe, the Great Grey Shrike is found in four different types of habitats: landscapes with dispersed fruit-trees and meadows ("Streuobst-Wiesen-"), landscapes with traditional mounds of stones and with open hedges ("Steinriegel-Hecken-"), landscapes with juniper heath "Wacholderheide-"), and landscapes with fenland ("Moor-Landschaften"). These habitats of the Great Grey Shrike are characterized by a semi-open structure, with subareas where woody-plants of different sizes grow in different densities. Because of the relatively large territories extending over at least 50 ha, the structure of the landscape as a whole is important.
2. Changes in the structure of the landscape were examined in the region of the southwestern Schwäbische Alb in a study area with numerous long-term breeding and winter territories (size of the plot: 121 km², Fig. 1142-1144), by comparing the situation before the year 1960, in 1978, and predicted for 1990 and later. This comparison showed that the merely extensively cultivated areas used by the Great Grey Shrike are strongly declining in their extension (in 1978: 53%, in 1990: presumably only 32% of their size in 1960, Table 257). The decline of the continuous extensively cultivated areas of larger size is even more drastic (areas with a size of more than 0,5 km²: only 18% of the areas in 1960 remaining in 1990, Table 258). This process is caused e.g. by the increasing dissection by the lines of roads and tarred farming lines, by the expansion of the settlement areas, and by changes in cultivation, and especially by new afforestation with spruce.
3. Nature conservation related data: Great Grey Shrikes show a year-round contact behaviour between their territories, and often they are breeding in loose groups. Therefore, suitable habitats should not be situated more than 2-3 km apart from each other. Isolated habitat patches are occupied only irregularly by the species. - Great Grey Shrikes are sensitive to disturbances, especially during the breeding period and to disturbances caused by dogs. - As nest-sites, Great Grey Shrikes prefer "wild", densely grown parts of woody plants. - The accessibility of food is crucial especially during periods of food-shortage, e.g. the access to small birds during periods of harsh weather. Then the "run wild", only very extensively cultivated parts of their habitats are highly important for still finding food.
4. Causes of decline: Mainly the large-scale intensification of land-use by farming, and the decline of insects and of wild herbaceous plants, in biomass as in species numbers, may lead to eventual food-shortage for the Great Grey Shrike. - The fragmentation of habitats, the increase of disturbances because of facilitated accessibility, and the removal of woody plants from landscapes by eradication of dispersed bushes and isolated trees, are also contributing to the decline of the species.
5. Proposals for necessary conservation measures: For protection of the Great Grey Shrike the following conservation measures are proposed: - the conservation of extended continuous extensively cultivated landscapes (e.g. landscapes with dispersed fruit-trees in remote locations, "Streuobst"; landscapes with traditional mounds of stones and with open hedges and their peripheral areas, "Steinriegel-Hecken"; landscapes with juniper heaths and with dispersed pine stands, cultivated as traditional sheep pastures with shepherds, "Hüteschafweiden" und "Holzwiesen"; fens and their peripheral areas); - the conservation even of small patches of less productive wasteland and fallow land in remote locations; - the prevention of the afforestation of such areas, e.g. on slopes or declivities; - the removal (deforestation) of first afforestation (and not a "completion" of wooded areas); - the establishment of non-cultivated or merely extensively cultivated patches ("stepping stones") in otherwise intensively cultivated areas, e.g. in the points of intersection of a grid with gridlines in distances of approximately 100 m; - the restriction of the access to the unsettled open landscape by limitation to the construction of tarred farming roads, in combination with the conversion of sections of such farming roads into gravel roads, and with the prevention of removing of the snow from such tarred farming roads in winter; - an ecological overall planning for current breeding territories of the Great Grey Shrike, with an assessment of the negative impacts of all intended projects (such as settlement and leisure areas, planning of new roads, new farming lanes, and of new cultivation regimes).
6. The Great Grey Shrike may be considered as a characteristic species of extensively cultivated landscapes, and as an indicator ('umbrella species') for many more endangered species. - Therefore, further research is required on the creation of new suitable habitat patches, on the steering and management of disturbances caused especially by leisure activities, and on the impacts of any land consolidation measures.
1. The bill of Shrikes Lanius narrows laterally towards the tip and is filled with spongiosa. The horny layer of the bill has a hook and a tomial tooth at its tip (in the upper beak) and a corresponding indentation (in the lower mandible, Fig.1). These structures develop in young Shrikes only after fledging (Fig.1e). The bill of Shrikes functions as a 'cutting edge' (Fig.2) with the tip as means for crushing with torsion ('crushing cutters').
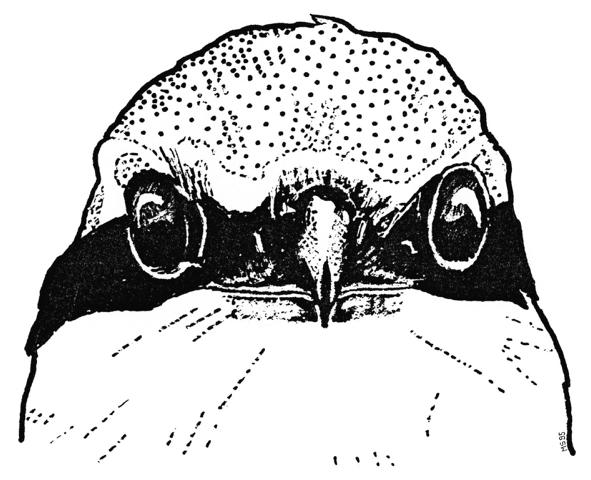
2. The eyes of Shrikes are slightly protruding and the adjacent areas of the head are slightly depressed (Fig.3). This helps to enlarge the field of binocular vision.
3. At the feet the central middle forward-directed toe and the backward-directed toe form 'gripping tongs', with the digital pads of the distal claw phalanges serving as abuttment for the claws (Fig.4).
1. Sex characteristics on the wing of the Central European Great Grey Shrike Lanius e.excubitor: The male shows a large speculum on the secondaries (extending to S6), no (or at most a weak) narrowing of the wing bar at the transition from hand to forearm on the spread wing, a large broad speculum of the tips of the remiges, and a «connection of the speculum on the base with the speculum on the tips of the secondaries», flashing during flight, and in addition broad light shoulder patches. In the female the speculum on the base of the secondaries is smaller, the speculum on the tips of the secondaries is narrower too, and a «connection» is missing, and the shoulder patches are smaller (Fig.1 - Fig.4). The pattern of the inner vanes of the secondaries is crucial for the formation of the sex characteristics, especially differences between male and female in the width of the light margin of the inner vanes (Fig.5). A reliable determination of sex is best possible in the flying bird, with a combination of characteristics including the «connection of the speculum on the base with the speculum on the tips of the secondaries» in the male (Fig.7, Fig.8). Separate characteristics of the wing pattern or sex characteristics on other parts of the body seem to be less effective for sexing (e.g. contrast of colour of the underside, tail pattern: Fig.10, changes in bill colour: Fig.11). These sex differences are equally observed in two populations 700 km apart in north-south direction (southwestern Schwäbische Alb and Eider-Treene area), and in breeding as well as in wintering birds (Fig.7). The differences are confirmed in museum skins (Fig.8). A comparison reveals that some of these sex characteristics are also known from other Central European populations of the Great Grey Shrike, other subspecies and other species of shrikes. In particular subspecies of Lanius excubitor senu lato with only one speculum on the wing and the North American L. ludovicianus, also with only one speculum on the wing, seem to possess comparable sex characteristics similar to those of the Central European subspecies L. e. excubitor with two speculae on the wing («connection extending from the tips of the secondaries», mainly according to observations at museum skins, Fig.14). An «inner wing bar», equivalent to the «connection of the speculum on the base with the speculum on the tips of the secondaries», is found as a general pattern of both sexes in some other species of the genera Lanius, Laniarius, Nilaus and Prionops (Fig.16). The bill colour changes seasonally: in the breeding season even the base of the lower mandible is dark respectively black. The change of bill colour during winter is retarded in females as well as in young birds of both sexes (Fig.11).
2. Age characteristics: A reliable determination of age is best possible with the light tips of the greater coverts in juvenile birds, which may be retained up to the spring of their second year (Tab.1, Fig.17).
3. Evolution of pattern: In the family Laniidae an «inner wing bar» has been developped convergently several times. The lack of a conspicuous sex dimorphism, as e.g. in Lanius excubitor, may be an adaptation to strong seasonal variations in food supply, caused by winter cold (in boreal or moderate climates), or by summer drought (in continental or subtropical climates).
4. Optical signals: In birds optical patterns seem to be formed often only by movement during the flight. Character and effectiveness of optical signals are influenced by several factors, on the side of the signal emitter: by the extent of overlap of the feathers (cf. Fig.6 with Fig.5: only visible parts are effective), by the location on the body, and by the colour of abutting feather tracts, which determines the degree of contrast either in the resting bird (Fig.20: "framing"), or in the flying bird ("flashing" of a signal); on the side of the signal receiver: by the degree of contrast against the background, by the distance from the emitter (low/high range signals, Fig.18, Fig.19), by the density of the habitat, and by the social behaviour (inter-individual distances). In Shrikes Lanius patterns with a strong contrast are found rather in open habitats and in resident species living as single pairs, patterns with low contrast rather in denser bush or wooded habitats and in group breeders or short-distance migrants.
5. Individual traits of the pattern: Free-living Great Grey Shrikes L. e. excubitor can be distinguished as individuals relying on a combination of characteristics of the eye-mask (Fig.21, Fig.22) and of the wing pattern. Such individual traits could serve as means for individual recognition for the birds themselves.
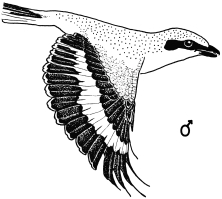
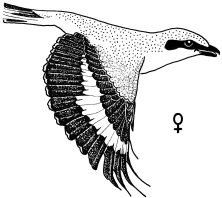
Fig.1 Sex characteristics on the spread wing of the flying Great Grey Shrike of the Central European subspecies L.e.excubitor, semi-schematic (left wing omitted).
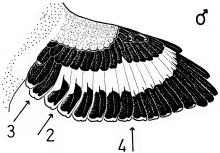
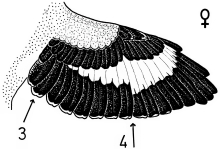
Fig.2 Sex characteristics on the spread wing of the Central European Great Grey Shrike L.e.excubitor: 2 = "connection of speculum on base of secondaries with speculum of tips of secondaries", 3 = speculum of the tips of secondaries and primaries (tips' speculum), 4 = transition of speculum on base of primaries to speculum on base of secondaries. Secondaries maximally spread to show their inner vanes.
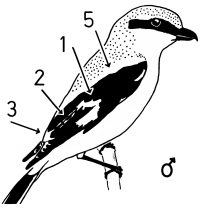
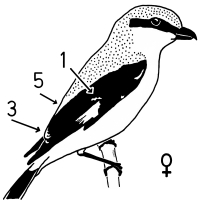
Fig.3 Sex characteristics on the folded wing of the perched Great Grey Shrike of the Central European subspecies L.e.excubitor, side view: 1 = speculum on base of secondaries (= "secondaries' speculum"), 2 = "connection of speculum on base of secondaries with speculum of tips of secondaries", 3 = patch formed by speculum of the tips of secondaries, 5 = shoulder patch (lighter stripe). Primaries weakly spread (outermost primary P10 visible).
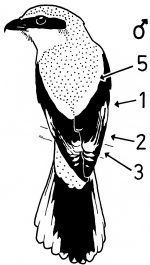
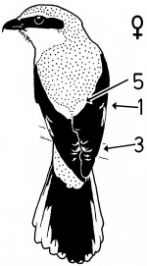
Fig.4 Sex characteristics on the folded wing of the Central European Great Grey Shrike L.e.excubitor, perching bird seen from behind: 1 = speculum on base of secondaries (= "secondaries' speculum"), 2 = "connection of speculum on base of secondaries with speculum of tips of secondaries", 3 = speculum of the tips of secondaries and primaries (tips' speculum), 5 = light shoulder patch or stripe.
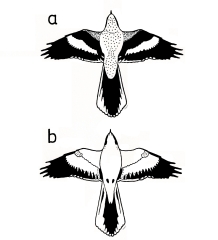

Fig.18 (top, left) Pattern of the flying male Great Grey Shrike Lanius e.excubitor of Central Europe: a) top view: white wing bar (speculum on base of primaries and secondaries), inner part of the front margin of the wing light grey-blackish, rear margin of wing white (speculum of tips of remiges), light shoulder patch, folded tail almost completely black (R1 visible); b) overhead view: translucent white wing bar, on inner webs of secondaries narrowing towards tip of feathers ("toothed"), white speculum of tips of remiges; remaining parts of remiges, including P10 and alula on front margin of wing: dull black, tinged grey (here: drawn as completely black); under major primary coverts: grey; folded tail: almost completely white (R6 visible); dotted parts = grey; semi-schematic ( b) slightly modified compared to published version).
Fig.19 (top, right) Signal pattern of the Great Grey Shrike Lanius e.excubitor during 'visual perching' with 'displaying of the underside': white underside (breast, belly, under tail coverts) framed with black: of front margin of the slightly spread wing (laterally), of eyemask and bill (at the top), of feet and inner rectrices (at the bottom); modified from a photo of V. Olsson.
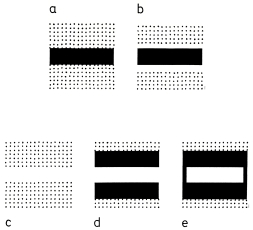
Fig.20 Intensification of the contrast of optical patterns (model): a), b) "framing" of black areas with small white zones: a) grey parts abutting on black stripe, b) white zone abutting; c) - e) "framing" of white areas with black zones: c) grey parts abutting on white stripe, d) black zone above and below, e) additional lateral black zone ("frame"); dotted parts = grey. Conclusion: areas "framed" are as a signal effective up to a greater distance than "unframed" ones.
1. Pair-formation is described by means of 5 behaviour patterns, which are: establishing contact between individuals, dominance relationships, and sharing of food between the individuals of the pair, nest-display and courtship behaviour. Social behaviour (Fig.1): On the study area birds in pairs are observed from early February to middle of July (M= 12.5. ), and rarely in autumn again. Before and after this pair-phase, contacts to individuals from outside the territory and 'group-meetings' (of on average 4 birds) are more frequent (Fig.1). Probably the 'group-meetings' take place most often, when several pairs begin to settle in direct vicinity to each other. This is suggested by progress and sites of 'group-meetings', as well as by participating individuals (mean distance to territory of origin: 1,72 km ). Similar characteristics seem to hold for the 'group-gatherings' in other bird-families. The timing of pair-formation is similar in all populations of L.e. excubitor in Central Europe. Dominance relationships (Fig.2): Connected with pair-formation is a change in dominance from female to male, which is discernible from perching-dominance of paired birds (perch-height), "drive-to-cover" (feint attacks), and sitting-in-cover. In tightly paired birds most often the male is dominant. A change in dominance, from individuals with equal rank to dominance of the male in pairs, is most probable in resident species, where both sexes winter in individual territories, and where the female is supplied with food by the male during incubation. Food sharing between male and female (Fig.3): Pair-formation is connected with a change for the female from self-supply to supply by the male. This change is accompanied by variation in frequency of self-hunting by the female (frequent until approximately 30 d before egg-laying), of alternate feeding at a larder (on stored prey supplied by the male), and of courtship feeding by the male (maximum 4 d before first egg). Copulations are most frequent 5 days before and after beginning of egg-laying. Food sharing starts after the change in dominance only. Synchronization of pairs in the population seems to be relatively high. During pair-formation male and female may store small prey at conspicuous, exposed places ("courtship-storing"). This prey may be used for courtship feeeding. Courtship feeding with inversed rôles (female feeding male) and "courtship-storing" by the female are connected with the change in dominance. Nest-site display behaviour (Fig.4,5,6): male, more often than female, indicate potential nest sites by slipping in thickets, hopping, and clinging to forks etc., and by a special nest-call. The maximum of nest-display is approximately 40 d before beginning of nest-building. Courtship behaviour (Fig.7): In close encounters of female and male during pair-formation and dissolution certain postures are shown: 'facing-away', 'bill-upright' and "sitting at angle" to each other, which are provoked mostly by approach to a partner. - During dissolution of pair-bond and autumnal beginning of pairing, pair-formation behaviour is rarely shown again (Fig.1). Birds holding together as pairs in winter are exceptions, which holds for other populations of L. excubitor and other subspecies too.
2. In visits to territories from outside during breeding-season, visiting shrikes can reach with prey to the vicinity of nest resp. territory center. Visitors are mostly males from the neighbouring territories, and often birds being already paired. Visits are most frequent shortly before and during egg-laying, and around fledging-time (Fig.8). Visits may be interpreted as contacts with birds of the other sex outside the own pair. Visitors and birds that are visited, and among them birds of both sexes, may determine the frequency of extra-pair contacts by sitting on exposed points or in cover. Extra-pair copulations (in visits of maels), or egg-dumping (visits of females) could occur. Visitors to broods with young can be accepted as helpers-at-the-nest.
3. Breeding season - egg-laying, hatching, and fledging: In the region of the southwestern Schwäbische Alb between start of nest-building and fledging of young pass on average 55 d (from April 21th to June 17th). The pairs are highly synchronized, with a mean duration of incubation of 19 d [17 d], and of nestling phase of 24 d [20-21 d] in the population [respectively in the single pair] (Fig.9). The beginning of laying can be postponed dependent on weather. Egg-laying takes place in Central Europe from end of march to middle of June, rarely until early July; breeding in autumn is an exception (Fig.10). Start of breeding can vary locally and over greater areas, with climate and food supply (dependent on latitude: approximately 30 d later per 10° northward, Fig.11). Southern subspecies of L. [excubitor] meridionalis have longer breeding seasons, with regular second breeding attempts in some populations. The resident species L. excubitor lays earlier than migrating Lanius species. The end of the breeding season varies to a lesser degree (Fig.11), and is determined by the decline of food supply in winter. At that time the last young should be completely independent and have improved their hunting efficiency. Therefore synchronization of pairs is advantageous. The length of the breeding season seems to be adapted to seasonal variation of temperature in northern populations, and to local variations of humidity in southern populations of L. [excubitor] meridionalis s.l.
4. Dissolution of families and pairs at the end of breeding season, brood-division and dispersion: In the study area, families of L.e. excubitor break up in several steps: fledging occurs at an age of the young of 20 - 21 d ; brood-division at approx. 30 d , last feed at 36 d , departure from the breeding territory of first resp. last young or adult at 40 d respectively 60 d , i.e. between July 7th (first) and 24th (last young). Unsuccessful pairs leave breeding places on average 34 d earlier than successful pairs, i.e. June 11th respectively July 15th, Fig.3). Young depart alone (52% of the juv.) or together with an adult (mostly the first one to leave). The lightest nestlings depart often as the last ones. Successful breeding birds depart separately one after another, pair-bond is dissolved. Unsuccessful breeding birds leave early in the season often joint, later more often single. Year-round residents are rare: only 1/10 of the shrikes wintering in the area, and 1/3 wintering at breeding places descend from the breeding population. After an unsuccessful breeding season, the adults are more often resident.
5. Brood-division, known from other groups of birds as well (see appendix P21 ), is controlled above all by food-supply. Division occurs more often: with greater or later broods; in years with poor food supply; in climatic zones with short breeding seasons. Division allows a better utilization of food and of parental investment. The process of family break up is similar in other populations of L.excubitor and Lanius species. Compared to birds of prey and owls, in shrikes the post-fledging period with dependent fledglings, in relation to the nestling phase, is elongated. In populations of L.e. excubitor in Central Europe, on a local scale and in at least 3 waves, strong seasonal movements take place. These movements are a result of emigration of local birds and immigration of more northern populations. Food-shortage in summer could induce even successful adults to leave their breeding places and surroundings at the end of the breeding season. For a description of these local, short-distance migrations conventional models on residents and migrants are scarcely suitable.
6. Pair-bond: As far as known, the subspecies L.e. excubitor, L.[excubitor] m. meridionalis, L.[exc.] m. aucheri, and perhaps L.[exc.] m. elegans, pair only for one season. Seasonal pair-bond could evolve through food-shortage in winter (caused by cold), or in summer (by drought), that in turn can force birds to disperse to single-bird territories. Pairing for life, previously suspected because of similar plumage pattern of the sexes, actually seems only to be an exception in any subspecies of L. excubitor (one case definitely proved up to now). The seasonal character of pair-bond seems to be even more marked in the southern subspecies of L. excubitor in climates with hot-dry summers and mild winters, than in northern subspecies, judging from weak breeding-site fidelity of females in southern subspecies. The individuals with the highest ranks in communally breeding African 'Grey Shrikes' Lanius show a form of pair-bond that is nearest to pairing for life. It is suggested that the Lanius excubitor-group is derived from such a tropical 'Grey Shrike'-ancestor, and that splitting into two groups of (southern resp. northern) subspecies occured through adaptations to different main groups of prey (ectothermic respectively endothermic animals), to different seasons of food-shortage (summer respectively winter), and to different habitats ("special sites with woody plants" in ecosystems otherwise free of woody plants, respectively "timberline"-habitats in wooded ecosystems).
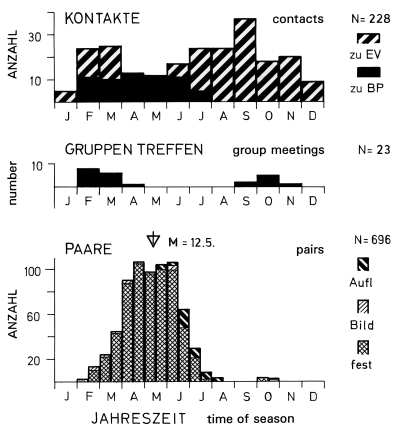
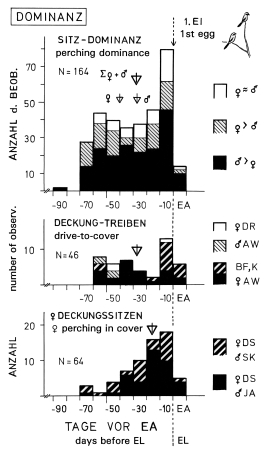
Fig.1 (top, left) Annual cycle of social behaviour of the Great Grey Shrike L.e. excubitor in the region of the southwestern Schwäbische Alb: 'contacts' with individuals from outside the territory (top), 'group meetings' (center), and observations of 'pairs' (bottom); M = median; contacts: zu EV = to single birds, zu BP = to breeding-pair; pairs: Aufl = weak pair-bond during dissolution, Bild = similar during pair-formation, fest = strong pair-bond; monthly totals, except for 'pairs' (half-monthly totals); data: 1975-89 for 85 pairs.
Fig.2 (top, right) Dominance relationships in breeding pairs during pair-formation of the Great Grey Shrike L.e. excubitor, in relation to egg-laying (EA = EL); black resp. dark hatched = dominance of male, white resp. light hatched = dominance of female; triangles = medians; perching dominance (top): > dominant over, ≈ same rank as (without short dominance-changes); drive-to-cover (center): ♀AW = female withdrawing, BF,K = during courtship feeding respectively during copulation, ♂AW = male withdrawing, ♀DR = female threatens, does not withdraw; ♀ perching in cover (bottom): ♀DS,♂SK = female in cover, male on sight contact, ♀DS,♂JA = female in cover, male hunting farther away from female. Totals for periods of 10 days, "EA"/ "EL" = 0-10 d after first egg; 1975-89.
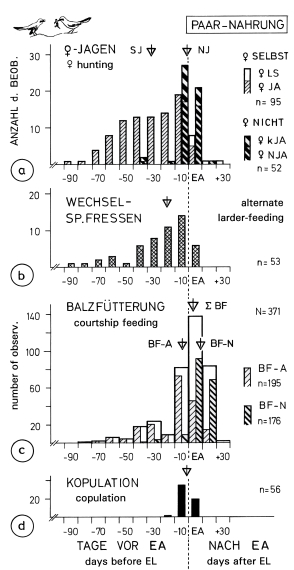
Fig.3 Division of food in breeding-pairs during pair-formation of the Great Grey Shrike, in relation to egg-laying (EA = EL); triangles = medians; a) ♀ self-hunting (SJ) and ♀ not hunting (NJ): ♀LS = short aerial captures of female in nest vicinity, ♀JA = female hunting for herself farther from nest, ♀KJA = female hunting shortly and without success, ♀NJA = female not hunting all the time; b) alternate larder-feeding of pair on prey provided by the male; c) courtship feeding (BF) of the female by the male: BF-A = outside the nest, BF-N= on nest, with ∑BF = BF-A + BF-N; d) copulations. Totals for periods of 10 days, "EA" = 0-10 d after first egg; 1975-85.
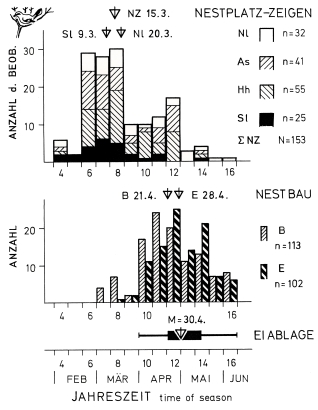
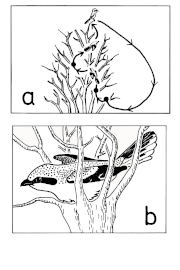
Fig.4 (top, left) Nest-site display and nest-building of the Great Grey Shrike in the region of the south-western Schwäbische Alb: seasonal sequence in totals of 10 days (counted from 1st January onward); triangles = medians; nest-site display (NZ): ∑NZ = total, Nl = nest attracting display with call, As = snuggling, Hh = hopping to potential nest-site, Sl = slipping through woody plant; nest-building: B = beginning, E = end (with completed nest); egg-laying: bar = range of quartils Q₁ – Q₃, thin line = complete period; data: 1976-1983.
Fig.5 (top, right) Nest-site display behaviour of the Great Grey Shrike L.e. excubitor: a) Slipping, by constantly moving with spread wings and tail; b) Snuggling at potential nest-sites with slightly spread wings and tail ( b modified after Panov 1983).
Fig.7 Courtship display of Great Grey Shrike L.e. excubitor: a) "facing-away" posture (top: front, bottom: rear), b) "steep-upright" respectively "bill upright" posture, c) "sitting at angles" (top: top-view, tails facing, center: side-view, bottom: topview, heads facing), male left, female right, right birds show "profile" ( a, b modified after Ullrich 1971).
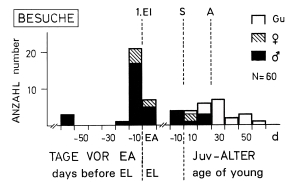
Fig.8 Visits from outside to breeding-territories by Great Grey Shrikes L.e. excubitor in the region of the southwestern Schwäbische Alb, in relation to breeding-cycle: 1.Ei = 1st egg, EA = egg-laying, S = hatching, A = fledging of young, Gu = sex unknown; totals for classes of 10 days (except: "EL"-class, lasting 4-8 d depending on clutch-size, and "class following EL": only 7 d , as hatching with 17 d ); data: 1976-83, for 16 pairs.
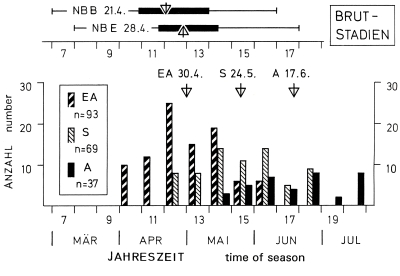
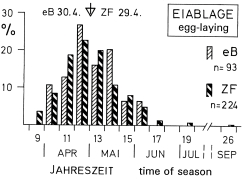
Fig.9 (top, left) Seasonal position of the breeding cycle of the Great Grey Shrike L.e.excubitor in the region of the southwestern Schwäbische Alb: breeding phases: NB B = beginning of nest-building (initial stage or 'outer nest', n=113), NB E = end of nest-building (with inner lining or empty completed nest, n=102), EA = egg-laying (first egg), S = hatching, A = fledging of young; nest-building: thin line = complete period, bar = range of quartils (Q₁ – Q₃); ⛛ triangles = medians (date); numbers of clutches respectively broods, in totals of 10 days (counted from 1st January onward); data: 1977-1984.
Fig.10 (top, right) Seasonal distribution of egg-laying of the Great Grey Shrike Lanius e.excubitor in Central Europe: percentage (%) of clutches started (first egg); in totals of 10 days, ⛛ triangles = medians; eB = own observations SW-Alb, ZF = accidental findings in Central Europe ( data: own compilation, for references see Fig.11 no.14).
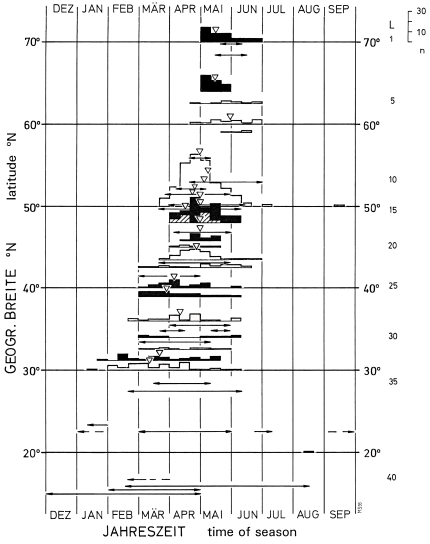
Fig.11 Breeding seasons of the Great Grey Shrike Lanius excubitor in the whole distribution range of northern and southern group of species (L. excubitor sensu stricto und L. meridionalis sensu lato): seasonal distribution of laying dates (first egg) in relation to latitude (°N); ▽ triangles = medians, open bars = accidental findings in a larger region, black filled bars = single populations, ← → lines with arrows = range (exact data not given); L = no. of reference (right margin, only every 5th no. indicated; for detailed references, see Ecol. Birds 16, 1994: 118).
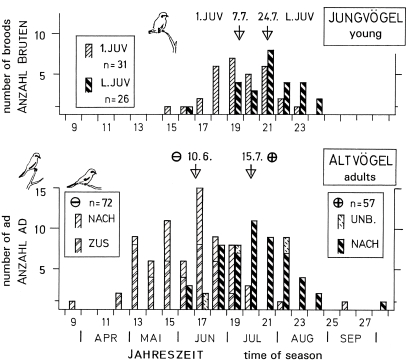
Fig.12 Family-dissolution of the Great Grey Shrike L.e. excubitor in the region of the south-western Schwäbische Alb: top: departure of young from natal territory, bottom: departure of adults from breeding-territory: successful (⊕) and unsuccessful (⊖) breeding-pairs; number of broods respectively adults (ad.): totals of 10 days (counted from 1st January onward) and medians (triangles ▽ ); young: 1.JUV = first juv., L.JUV = last juv. of the brood; adults: nach = successively, zus = together, unb. = unknown if successively ("nach") or together ("zus"); in each class of 10 days: left column = unsuccessful pairs, right column = successful pairs; data: juv. 1977-1983, ad. 1975-1984.
1. In the study area, the mean clutch size is x = 6,00 eggs and the mean brood size is x = 4,5 (- 5,6) fledged juv. (Fig.1). The sex ratio in fledged broods is balanced (42 males, 42 females). In other Central European populations of L.e. excubitor the sizes of clutches and broods are similar (accidental findings: x = 6,10 eggs per clutch, Fig.2; x = 4,43 juv. per brood, Fig.3). Southern subspecies of L. [excubitor] meridionalis have smaller clutches than northern subspecies (Fig.2). Clutches seem to be smaller in habitats with hedges and heath or with mires, and larger in habitats with orchards or in steppe and semideserts (Fig.2). In Central Europe the clutches of the resident species L.e. excubitor are mostly larger than the clutches of the long-distance migrant Lanius-species (Fig.2). Reversely the brood sizes (juv. per successful nest) of the long-distance migrant Lanius-species are often equal to those, or even larger than in the resident species L.e. excubitor (Fig.3, cf. Fig.7).
2. The geographical variation of clutch size can be explained as an adaptation either to the maximum number of young which the adults are capable to rear, or to the probability of surviving outside of the breeding season, or to the frequency of nest predation. The variation in the size of fledged broods (cf. Fig.3) may be caused by adaptations to rapid changes in food supply.
3. In the region of the southwestern Schwäbische Alb about 40% of the breeding pairs and of the nests and about 30% of the eggs are successful in producing fledglings (Fig.4). Breeding success of pairs is higher: in the part of the study area lying on the plateau of the Alb during all years, and in habitats with traditional orchards in years with late start of laying, and in multiple breeding attempts. In the part lying in the foreland of the Alb, breeding success and breeding density are correlated (Fig.5). Brood losses are increasing directly after hatching (Fig.6), and about 50% are caused by wet and cold weather, and about 30% by animals. A breeding pair starts on average 1,4 nests and 1,2 clutches per year (maximum breeding persistence: 2% of the pairs with 3 clutches). A further breeding attempt is more likely after a loss early in the season or after loss of small nestlings. Between loss of a brood and start of a replacement clutch pass on average about 8 days, the interval is shorter after a loss of eggs.
4. In Central Europe in the long-distance migrant species Lanius collurio, L. senator, L. minor breeding success is mostly higher and reversely clutch size and breeding persistence are mostly lower than in the resident species L.e. excubitor (Fig.7, cf. Tab.1, Tab.2). In the region of the southwestern Schwäbische Alb the proportion of successful eggs is relatively low. The smaller clutches (and partly higher breeding success) in areas with hedges and heath or with mires can be explained as an adaptation to weak fluctuations of food supply, reversely the larger clutches in areas with traditional orchards or with semidesert (cf. Fig.2) as an adaptation to stronger fluctuations. In Central Europe in Lanius-species brood losses are caused above all by wet and cold weather, and are most frequent during egg-laying and hatching. In hot and dry climates animals are causing most losses, in wet and cold climates the weather is more important, modified by different sensitivity of the species. Breeding persistence and intervals between successive attempts after a loss depend strongly on the physiological constitution of the female, which in turn depends on the development of additional egg-follicles and on the energy reserves of the female. Both factors can overlap in their effects, which explains the great variation of the intervals between breeding attempts after a loss.
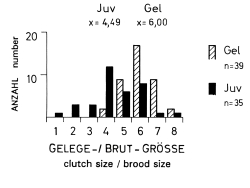
Fig.1 Clutch size and brood size of the Great Grey Shrike Lanius e.excubitor in the region of the southwestern Schwäbische Alb: Gel = number of eggs in complete clutches, Juv = minimum number of fledglings per brood (N=157 juv.); x = arithmetic mean, n = number of clutches, or broods.
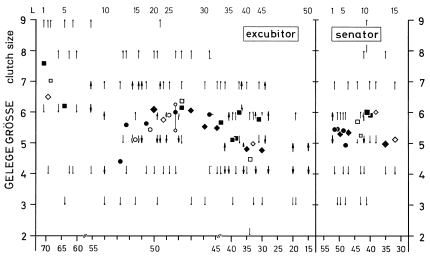
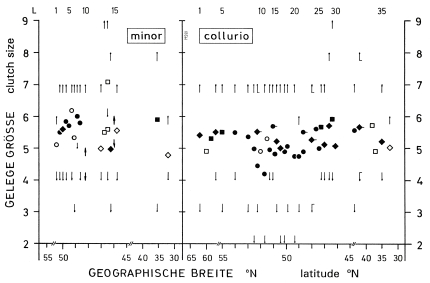
Fig.2 Clutch size of Shrikes Lanius in Europe and northern Africa, in relation to latitude (°N): latitudinal trend in L. excubitor, merely absent in L. collurio; for L. excubitor: relatively larger clutches in semideserts (e.g. no.28, 38, 44), smaller clutches in habitats with hedges and mires (e.g. no.10, 11, 13, 19, no.26 HH); arithmetic mean (symbols) and range of complete clutches; symbols: ● ■ ◆ filled symbols: n>10, ○ □ ◇ open symbols: n≤10; ● circles = distinct populations in Central Europe, ■ squares = distinct populations outside of Central Europe (for species group of Lanius excubitor: in other subspecies except Central European L.e. excubitor), ◆ rhombus = accidental findings from a larger area with different populations, ●- dash to the right = mainly first clutches; ⎹ vertical thin lines = range of values, ↕ vertical thick lines with arrows = range of mean (most frequent sizes) with (n?). Upper row: L = no. of reference in literature, for each species separately counted (only every 5th no. indicated; for detailed references, see Ecol. Birds 16, 1994: 181-183).
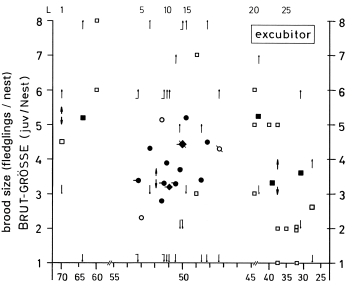
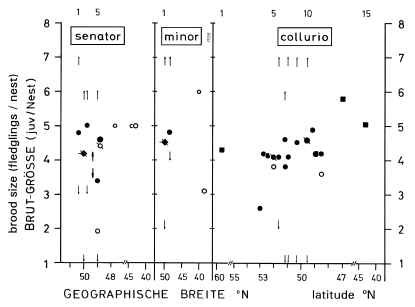
Fig.3 Brood size of European Shrikes (Lanius), in relation to latitude (°N): relatively large broods in long-distance migrant species L.senator, L.collurio; number of fledglings in successful broods, arithmetic mean (symbols) and range; symbols: ● ■ ◆ filled symbols: n>10, ○ □ ◇ open symbols: n≤10 respectively smaller number of two means; ● circles = distinct populations, ■ squares = distinct populations outside of Central Europe (for L. excubitor: subspecies different from L.e. excubitor), ◆ rhombus = accidental findings from a larger area with different populations, -● dash to the left = partly broods already fledged some days, \ oblique dash crossing = partly broods not yet fledged (age of ringing), smaller symbols = single broods (n=1); ⎹ vertical thin lines = range of values, ↕ vertical thick lines with arrows = range of mean (most frequent size) with (n?). Upper row: L = no. of reference in literature, for each species separately counted (only every 5th no. indicated; for detailed references, see Ecol. Birds 16, 1994: 186-187).
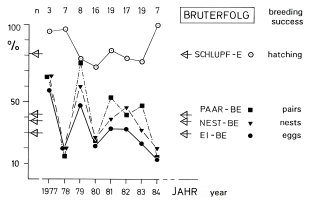
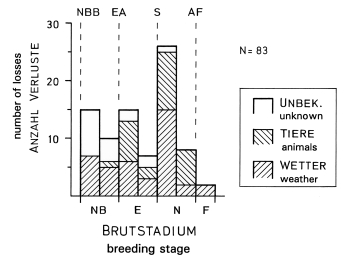
Fig.4 (top, left) Variation from year to year of the breeding success (%) of the Great Grey Shrike Lanius e. excubitor in the region of the southwestern Schwäbische Alb 1977-1984: success up to fledging, with: proportion of successful eggs = 'egg success' (Ei-BE ● ), ... nests = 'nest success' (Nest-BE ▼ ), ... breeding pairs = 'pair success' (Paar-BE ■ ), ... of hatched eggs = hatching success (Schlupf-BE ○ ); ◁- horizontal arrows = mean of total of all years (with: 530 eggs, 429 hatchlings, 157-197 fledglings, 93 nests, 96 breeding pairs, 35 successful pairs); upper row: n = number of pairs.
Fig.6 (top, right) Stages and causes of brood losses of the Great Grey Shrike Lanius e.excubitor in the region of the southwestern Schwäbische Alb; points (hatched lines): NBB = beginning of nest building, EA = egg-laying (first egg), S = hatching, AF = fledging; breeding stages: NB = nest building (first half: up to completion of 'outer nest', second half: up to completed nest without eggs), E = eggs, incubation (first half: including egg-laying), N = nestlings (two sections of equal length), F = fledglings still dependent (up to 5 days after fledging); unbek. = unknown cause; only losses of complete nests, clutches or broods; data: 1975-1984.
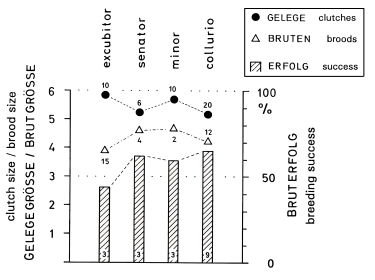
Fig.7 Average clutch size, average brood size, and average breeding success of the four species of Shrike Lanius in Central Europe: the long-distance migrants L. senator, minor, and collurio on average with smaller clutches, but higher breeding success, compared to the partial migrant L. excubitor; "weighed" arithmetic mean of the values from different populations (following a suggestion of Schulze-Hagen, Leisler & Winkler): xg = ( ∑ ni xi ) / ( ∑ ni ) , with ni = number of clutches, broods, nests, xi = arithmetic mean of population i ; ● clutch size, △ brood size (fledglings per nest), hatched bars = breeding success (proportion of successful nests); numbers = number of populations respectively studies used for computation. Totals of clutches na, of broods nb, of nests nc: see German version ("Gesamt-Anzahl"); data for Central Europe (47°-54°N), omitting studies for only one breeding period; for detailed references, see Ecol. Birds 16, 1994: 181-183, 186-187, 194-197).
1. In the region of the southwestern Schwäbische Alb the breeding density of the Great Grey Shrike Lanius e.excubitor is about 3 pairs per 100 km² and winter density about 7 birds per 100 km² (Fig.1, ratio breeding : winter = 1 : 2,3 ). The sex ratio in the wintering population is biased (Fig.2, male : female = 1,7 : 1 ); more adults than juveniles winter at breeding sites (Fig.3, ad. : juv. = 1,8 : 1 ). About 40% of the wintering birds, and of these more adults than juveniles, breed in the study area in the following year; about 10% of the wintering birds and probably only 5% of the breeding birds remain for over a year in the study area. The observed maximum age of a Great Grey Shrike observed is 4,5 years. The breeding population is declining, especially on the part of the study area in the foreland of the Alb (Fig.1). In Central Europe the population density of L.e. excubitor is mostly 5 - 10 (weighed average: 6,40 ) pairs per 100 km² (breeding) and 5 - 11 (weighed average: 7,61 ) birds per 100 km² (winter; Fig.5; relation of densities breeding : winter = 1 : 1,2 ). Even though the population can be higher in winter, because shrikes also occupy non-breeding areas. In northern subspecies population density seems to be only slightly lower than in the Central European L.e. excubitor, reversely in southern subspecies density can be considerably higher (Fig.5).
2. In Central Europe short-term fluctuations in density seem to occur rather simultaneously in different winter populations, but with local differences in breeding populations. The breeding density in a population can vary greatly between different parts of an occupied area, and fluctuate from year to year. Long-term changes in density are observed in northern Europe and the eastern parts of Central Europe (increase 1950-1970/1980), and in the southern parts of Central Europe (decline after 1950). Causes of fluctuations can be fluctuations in food supply (rodents), changes in land-use, and increasing disturbances by human leisure activities.
3. The Central European subspecies L.e. excubitor is a partial migrant, with the majority of females leaving in winter. Surprisingly in southern subspecies (L.[excubitor] m. meridionalis, L.[exc.] m. elegans, L.[exc.] m. aucheri) the females seem to be even more migratory. An interspecific comparison for Europe reveals that breeding site fidelity seems to be stronger in Lanius collurio than in L. senator, L. minor and in L.e. excubitor of the southwestern Schwäbische Alb; and in males of L.[exc.] m. meridionalis and L.[exc.] m. aucheri stronger than in L.e. excubitor. In Lanius excubitor winter site fidelity is observed for up to 3 - 4 years, which may thus be the average life expectancy.
4. In the region of the southwestern Schwäbische Alb about 60% of the Great Grey Shrikes breed and winter in groups (breeding: max. 5 pairs on 2,5 km², winter: max. 5 birds on 5,3 km² ), consisting of on average 3,22 breeding pairs respectively 3,90 wintering birds. The mean distance of the territories (home ranges) in a group is just under 2 km (intra-group distances: breeding: 1,63 ±0,31 km , winter territories: 1,68 ±0,20 km ), and the mean distance between the groups is about 4 - 6 km (inter-group distances: breeding: 6,66 ±1,36 km , winter groups: 4,14 ±0,38 km ; Fig.4). Pairs breeding in the center of larger groups show a higher breeding success. Traditions in territory occupation can be established at least in winter: territories in the neighbourhood of territories occupied for a longer period are preferred (significant correlation in relation to occupation period). Formation of groups seems to be an essential part of the social behaviour of the Great Grey Shrike and other Lanius species. Yet in all subspecies of L. excubitor the minimum distance between nests of neighbouring pairs never seems to be smaller than about 100 m . Advantages of breeding-groups may be improved protection against predators and a reduction of disturbances by conspecifics during breeding (via enhanced synchronicity); advantages of winter-groups may be the attraction of arriving migrant conspecifics in spring which could lead to earlier pair-formation.
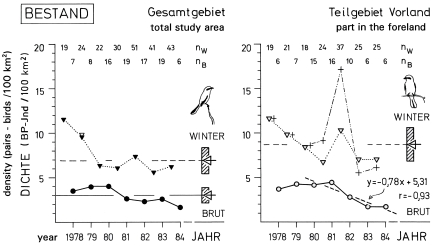
Fig.1 Breeding density (pairs/100 km²) and winter density (birds/100 km²) of the Great Grey Shrike Lanius e. excubitor in the region of the southwestern Schwäbische Alb: on the total study area (left) and on the part of the study area in the foreland of the Alb (right); significant decline of breeding density in the foreland area (linear regression given); symbols: ▼ ▽ triangles (Winter) = winter density, ● ○ circles (Brut) = breeding density, + crosses = winter-density on partial area A in the foreland, ◁- arrow and hatched bar (on right margin each) = arithmetic mean ± standard deviation; numbers: nW = of wintering birds, nB = of breeding pairs; for total study area: ▽ open triangle, winter 78/79 = density for n=39 birds (including 15 birds with unknown sex and age in a future part of the expanded study area).
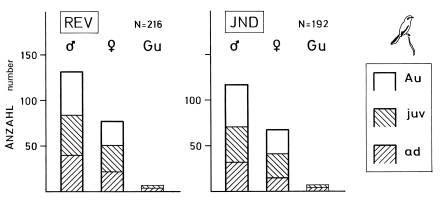
Fig.2 Age and sex ratio of the wintering population of the Great Grey Shrike Lanius e. excubitor in the region of the southwestern Schwäbische Alb, with a surplus of males. REV = in relation to territories ('wintering events' for each winter separately), IND = in relation to distinct birds ('individuals', birds being present for several winters counted once only); age, sex: ad = adults (young of previous year and older), juv = juveniles (young of this year or previous year in their first winter), Au = age unknown, Gu = sex unknown; for age and sex characteristics used, see Schön 1994, Ökol. Vögel 16: 11-80; data: winters 1977/78-1986/87 (without Au-Gu-birds).

Fig.3 Age and sex ratio of the wintering population of the Great Grey Shrike in the SW-Alb region, with regard to the location of the winter territories in relation to breeding territories: wintering inside and outside of last year's or future breeding territories. More adults wintering at breeding sites. Classification: innerhalb / inside = wintering at breeding site, ausserhalb / outside = wintering at site occupied only during winter; Jahr davor / previous year = winter territory in relation to breeding territory of the previous year, Jahr danach / next year = winter territory in relation to breeding territory of the next year; for further abbreviations, see Fig.2; data: winters 1977/78-1986/87 (without Au-Gu-birds).
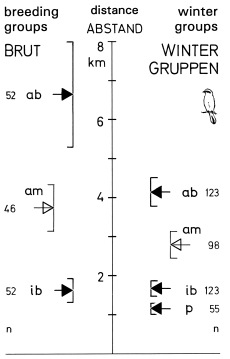
Fig.4 Distances (km) of territories (home ranges) in breeding- and winter-groups of the Great Grey Shrike L. e. excubitor in the region of the southwestern Schwäbische Alb: arithmetic mean (triangles) ± 99%-confidence interval (lines); breed = in breeding-groups (of ≥2 pairs, at 8 group-sites), winter = in winter-groups ( ≥3 birds, at 9 group-sites); ab = distance to next occupied territory outside of group, am = distance to next possible territory outside of group (not occupied in the year concerned), ib = distance to next occupied territory inside of group, p = distance between two especially close neighbouring territories ('winter-pairs', partly ouside of groups); n = number of distances (total of all years); for every year separately: as many distances measured as territories are occupied.
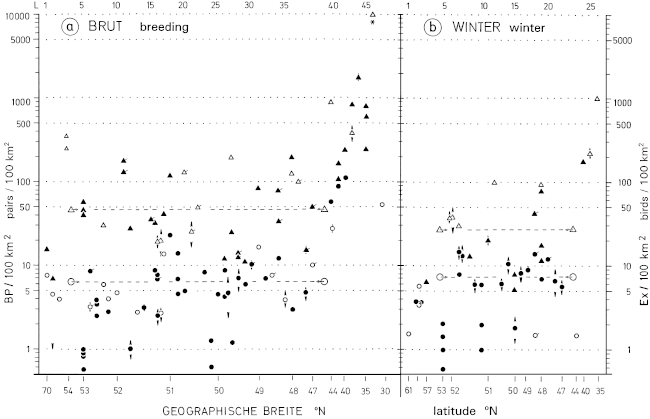
Fig.5 Breeding density ( a) pairs/100 km²) and winter density ( b) birds/100 km²) of the Great Grey Shrike Lanius excubitor, in the whole distribution range of northern and southern group of species (L. excubitor sensu stricto und L. meridionalis sensu lato), in relation to latitude (°N): density in a logarithmic scale; latitude: approximate value (ordered by sequence, no linear scale), different parts of a region in same vertical line; symbols: ▲ △ triangles = maximum values, ● ○ circles = averages, filled symbols = values for larger samples ( ▲ n≥5 pairs respectively ≥6 birds, ● n≥11 pairs respectively ≥11 birds), open symbols = values for small samples ( △ n≤4 pairs respectively ≤5 birds, ○ n≤10 pairs respectively ≤10 birds), ↕ symbol with arrows = arithmetic mean of two extreme values (arrows = range), ́ oblique dash (to the top and right) at the symbol = older data from before 1970; dashed lines = "weighed" arithmetic mean for Central Europe ( △→ – ←△ upper line for maximum values, ◯→ – ←◯ lower line for averages); uppermost row: L = number of reference (only every 5th no. indicated; for detailed references, see Ecol. Birds 16, 1994: 233-234).
1. Seasonal utilization, territory sizes.
1.1 Seasonal utilization: In the region of the southwestern Schwäbische Alb, the habitats of the Great Grey Shrike encompass about 8% of the total study area of 800 km². In this region there are twice as many winter as breeding-territories, with 9/10 of the breeding-territories used permanently (Tab.1, Fig.6). Between 50-75% of the habitats of the Great Grey Shrike consist of areas used only in winter, and merely 10-25% of areas used year-round (Fig.7). Two types of habitats are used by the Great Grey Shrike in this region: areas with traditional orchards (Fig.2,3) and areas with hedges and heath (Fig.4,5). In areas with hedges and heath, the proportion of territories used only in winter is greater than in areas with traditional orchards. At least 1/4 of the wintering population consists of individuals which are not adults of the local breeding-pairs. "Free places" among the winter-territories, which could be used by young or immigrants, are more frequent in areas with hedges and heath. Seasonal changes in utilization of different partial areas may be viewed as spatial shifting, dependent on fluctuations in food supply.
1.2 Territory sizes: The mean size of winter-territories of single birds is about 52 ha, that of the breeding-territories of paired birds 35 ha , and of permanent territories at a given site 68 ha (Fig.8; here: territory = home range of shrikes at a given site). Winter-territories in areas with traditional orchards are larger than in areas with hedges and heath. Similarly in other populations of L.e.excubitor in Central Europe breeding-territories (frequently: 20-50 ha , weighed average: 43,46 ha ) are smaller than winter-territories ( 50-90 ha , weighed average: 56,09 ha ), with strong variations. Over large parts of the distribution range of L.excubitor, territory-sizes show strong overlapping, although largest territories are observed in northern subspecies, and smallest in southern subspecies. In the past territories in Central Europe used to be smaller (Fig.9). In Central Europe breeding/winter - variations of territory-size are stronger in bird-predators (e.g. Accipiter nisus, A. gentilis) than in rodent-predators (e.g. Buteo buteo, L.excubitor). For Lanius-species, that breed in single pairs, the correlation between body-size and territory-size is not linear. In relation to body-weight, the breeding-territories of L. collurio, L. collaris and L. sphenocercus are rather too small, those of L. excubitor and northern populations of L. senator are rather too large (Fig.10). Territory-size depends strongly on food-supply that is effectively available. Differences in territory size between the northern and the southern group of subspecies of the Great Grey Shrike seem to be due to differences in dietary range (endothermic respectively ectothermic prey), in connection with an abrupt change of prey-groups (and not a gradual transition), and an increase in prey-density, in passing from cold to hot climates. This would explain the smaller territory-size of the desert-inhabiting subspecies L.[exc.] merid. elegans and L.[exc.] m. pallidirostris in the southern group of subspecies.
2. Structural Characteristics of the Habitat.
2.1 Distances: Breeding / winter - differences: Distances of woody plants in areas used exclusively respectively also in winter are larger than in areas used only in summer during breeding-time (Fig.13, 14). Likewise the range of distances (range of quartiles Q3-Q1) is larger in winter than in breeding-territories (Fig.16). Winter-territories at year-round occupied places and at places occupied only in winter show similar distributions of distances; only in parts territories used only in winter are more open. Typical for habitats of the Great Grey Shrike in all seasons is a small-scale alteration of densely and loosely stocked areas (Fig.15: "variety of distances"). Distances of woody plants are smaller in breeding-territories that are used for a longer period (Fig.16). Breeding-territories used only once have distances similar to longer used winter-territories. Averages: In habitats of the Great Grey Shrike in the region of the southwestern Schwäbische Alb, the mean distance of woody plants is M= 35,88 m (Fig.12); 3/4 of all distances are smaller than 100 m . Mean perch-distances in rarely used areas show an upper limit at about 50-60 m . The mean distance in breeding-territories is about M= 30 m , in winter-territories about M= 45 m (Fig.13). Correspondingly in succession from 1 ha grid-squares used only during breeding-time and those used permanently to those used only in winter, the proportion of large distances ( > 100 m ) is increasing, and the proportion of small distances ( < 20 m ) is decreasing (Fig.14).
2.2 Perch-Density: Breeding / winter - differences: The density of perches is greater on areas used during breeding-time than on areas used in winter (Fig.19, Fig.20). In a winter-territory about 55% of the area are very open (0-4 perches / ha), and 20% are very dense parts (10-500 perches/ha); in a breeding-territory about 40% of the area are very open, but 35% are very dense parts. Irrespective of season, areas of intermediate density (5 10 perches/ha) form about 25% of the total area (Fig.21). Averages: In habitats of the Great Grey Shrike in the region of the southwestern Schwäbische Alb, the average density of perches is about 5 perches/ha (perch-free 1 ha grid-squares included, Fig.18; median of perch densities determined separately for each 1ha grid). Open and densely stocked areas alternate on a small scale (Fig.18, 21). Compared to wooded land, habitats of the Great Grey Shrike are semiopen landscapes. As sole perches, wooded parts are found in every 30th, artificial perches in every 100th 1 ha grid-square.
2.3 Basal-areas: There are no marked seasonal differences in the size of basal-areas of woody plants: they are the same size in breeding and winter-territories. The same holds true for wooded parts. Minor shifts in size are detectable for parts of the territories only: woody plants are smaller in parts used only in breeding-time as compared to parts used whole-year or only in winter. This means that the variance in size of basal-areas is greater inside a territory than the variance between parts used in different seasons. In the habitats of the Great Grey Shrike, isolated woody plants are as broad as they are high, with a mean of about 6 m . Averages: In habitats of the Great Grey Shrike in the region of the southwestern Schwäbische Alb, woody plants have a mean basal-area size of M= 31,07 m². 4/5 of the woody plants are < 100 m² , 1/4 < 6,3 m² (Fig.23). In parts used regularly, there is an upper limit of basal-area size at about 40 m² . Forested areas, found in 1/4 of the 1 ha grid-squares, have a mean size of about M= 1800 m². The mean size of basal-areas is about M= 22 m² in parts used only in breeding-time, and about M= 33 m² in parts used year round or only in winter. The total cover of woody plants (wooded parts included) is maximally 17-21%, the cover of isolated scattered woody plants only (wooded parts excluded) 11-14% of the total area (estimated from averages of size and densities of single woody plants).
2.4 Types of Woody Plants: Seasonal differences: In winter-territories of the Great Grey Shrike, the number of hedge-like structures, of isolated bushes, and of hedges s.str. is greater than in breeding-territories at the same place (Fig.24). Reversely the density of tree-like structures and woody plants as a whole is greater in breeding-territories (Fig.25). For breeding-territories a significant correlation holds: the longer a territory is used, the greater the density of woody plants. Averages: In habitats of the Great Grey Shrike in the region of the southwestern Schwäbische Alb, there are more hedge-like structures (6/ha) than tree-like structures (4/ha), and in 1/3 of the 1 ha grid-squares there are forested parts. The majority of tree-like structures are isolated trees (92,0%), and most of the hedge-like structures are isolated bushes (85,8%). In a breeding (respectively winter )territory there are 200 (180) tree-like structures and 110 (170) hedge-like structures; a permanent territory comprises 300 tree- and hedge-like structures each (Fig.24, cf. Fig.25).
2.5 Distribution of Types of Woody Plants: Seasonal changes: In areas used during breeding-time, the part characterized by habitat specific types of woody plants is greater than on areas used in winter (i.e.: proportion of 1 ha grid-squares characterized by fruit-trees in habitat with traditional orchard respectively by juniper in habitats with hedges and heath). In areas used in winter, the part characterized by hedge-like structures, common to both habitats, is greater (Fig.27). Habitat characteristics in the region of the southwestern Schwäbische Alb: in habitats with traditional orchards 40% of the area (resp. the grid-squares) are characterized by hedges and 60% by fruit-trees; in habitats with hedges and heath 80% of the area are characterized by hedges and 12% by juniper-bushes (Fig.26). Conifer plantations are frequent especially in orchard and in foreland-districts (15-20% of the 1 ha grid-squares), and in winter-territories. Reversely, timber forests (20%) and naturally grown pine-woods (plateau: 10% of the 1 ha grid-squares) are more frequent in hedges and heath- respectively in plateau-districts. Wet places are an important part of the Great Grey Shrike-habitats (foreland: hedges along brooks: in 20%). Artificial perches (electric power lines, gardens in fields, railway embankments with telegraph poles, trees along roads) are of minor importance (only in 1-3% of the 1 ha grid-squares).
2.6 Main sites, roosting sites, and moulting sites: A territory of the Great Grey Shrike comprises 4-5 main sites, with a basal area of approximately 300 m² each, that serve as feeding , resting and look-out-places, and 2 roosting sites, and 1 moulting site, that serves as a main location during the moulting period. Main sites used in summer are smaller than those used in winter. Most frequent sites are: hedge-like structures (Fig.28a) with thorn bushes, bordering on perch-free zones. The roosting point within a roosting site is mostly situated in the centre of the woody plant, while resting points within a moulting site are more often at the periphery of the woody plant (Fig.28b). Important criteria for the selection as main site or roosting site seem to be protection (through cover and thorns) from predators, and from loss of body heat / from cooling; and in addition as to moulting sites, the possibility of sun-bathing.
2.7 Comparison of Structural Characteristics: As to general structural characteristics, in habitats of the Great Grey Shrike in the region of the southwestern Schwäbische Alb, there are about 10 [5] woody plants per ha (with [without] consideration of distribution; Fig.25 [Fig.18]), equal to a mean distance of about 35 m (Fig.12), and with a mean size (basal-area) of about 30 m² (Fig.23). For the distances of woody plants, there is an upper limit at about 1,7 times the mean (equal to mean distances of 50-60 m ), and for basal-areas of woody plants at about 1,2 times the mean (equal to mean diameters respectively mean heights of about 7 m ). The semiopen habitats of the Great Grey Shrike are characterized by an alteration of denser and more open parts, with smaller and greater woody plants (variety in distances, densities, and size of basal-area of perch-plants). The range of distances and of sizes of woody plants can be viewed as habitat-requirements of the species L. excubitor. Habitat differences between areas with traditional orchards (SO) and with hedges and heath (HH) concern special structural characteristics, such as the proportion of habitat-specific structures (Fig.21,30) and the basal-area of woody plants (SO about 40m², HH about 25m², Fig.29). Habitat differences are reduced by a higher proportion of high forest in areas with hedges and heath, and reversely a higher proportion of young afforestations in areas with orchards (cf. Fig.31). A year-round territory comprises about 450 tree-like and 150 hedge-like structures in areas with traditional orchards, and about 450 hedge-like and 150 tree-like structures in areas with hedges and heath (Fig.32). Seasonal differences show up in general structural characteristics, such as number and distribution of woody plants. Parts of the habitats used during breeding-time are denser and characterized rather by tree-like structures, parts used in winter are more open and mostly with hedge-like structures. During breeding-time rather habitat-specific structures are characteristic, in winter more often structures in common to both habitats.
3. Changes in the Structure of the Landscape and the Accessibility: In habitats of the Great Grey Shrike in the region of the southwestern Schwäbische Alb, woody plants were much smaller in 1956 than in 1979. The mean size of basal-areas increased from M= 12,85 m² to M= 34,03 m²; and the proportion of woody plants < 25,0 m² decreased from about 75% to 45% (Fig.33). The mean area of the forested parts in the 1 ha grid-squares increased distinctly too. The mean distances of the woody plants increased from M= 24,38 m to M= 30,88 m (Fig.34). The accessibility of the territories of the Great Grey Shrike has been facilitated. 1988 only 23,1% of the territories were situated in areas still without tarred farming-roads (cf. 1956: 100,0% ). But even today 58,7% of the territories are crossed by earth-grass-ways only (and not by tarred farming-roads). Permanent territories (P) are situated more often in areas without tar-asphalt farming-roads than territories used only in winter (P: 41,5%, OW: 19,0%). This can be attributed to diminished access of the areas in winter. 91,3% of the territories are situated in remote parts of the district or council areas: on the borders of these areas, or in the most distant parts of the open country (Fig.35). The avoidance of disturbances could be the reason for the position of territories. The increasing distances and basal-areas of woody plants in the habitats of the Great Grey Shrike are reflecting the changes in the visual structure of landscapes in the entire Central Europe in the 20th century. These changes are: the well-scattered isolated bushes and trees disappear from intensively cultivated areas, while the parts no longer under cultivation become overgrown with bushes and wood (Fig.36-Fig.38).
4. Spatial Structure of the Habitats and Visual Contact-Behaviour
4.1 In the region of the southwestern Schwäbische Alb, territories of the Great Grey Shrike are situated mostly at ranges of low hills or on rounded hilltops (Fig.39,40). Narrow and marginally wooded valleys are avoided. Between neighbouring territories visual connection is possible (Fig.41, Fig.42). In the territories, the main-sites, roosting , moulting and nesting-sites are located at exposed places too (Fig.43), and show good visibility. The surveyability of the territories is important for accessibility of food and protection against enemies, especially for perch hunters like L. excubitor. Differences in the topographic structure of the landscape may result in different surveyability.
4.2 Visual contact-behaviour includes visual perching and visual high flights. For visual contact, mostly survey-points, e.g. hilltops or upper edges of slopes, are visited (Fig.44). Points used for visual perching can be situated on the border or in the center of territories, during breeding-time more often in the center. When visually perching at the same time, the mean distance between two Great Grey Shrikes is about 400 m . During visual high flights, which cover a mean distance of about 400 m in a height of 50 m , a territory-owner moves outward in centrifugal direction on average to the border of the territory, while individuals from outside approach in centripetal direction on average to the margins of the territory (Fig.45). Visual contact-behaviour is frequent during pair-formation, family-dissolution and occupation of winter-territories (Fig.46). Visual perching is mostly performed by two individuals, and more often by males; visual high flights mostly by only one individual, and by males and females with equal frequency. Visual perching is often connected with showing the underside, at least by one of the participants, which occurs at a mean distance of about 400 m . Visual contact-behaviour of the Great Grey Shrike serves most often as territory advertisement (cf. Fig.45), and is frequent during relocation movements in the population. Breeding-territories are mostly advertised by males. The distances of two individuals in visual perching, as well as the extremes of distances from/to territory center in visual high flights are in the same order of magnitude as territory-size, and also reflect seasonal differences in territory-size. A lower limit of individual distances of about 150 m (when perching) respectively 65 m (when in flight) is rarely broken. L. excubitor possesses extraordinary visual faculties. This can be concluded from maximum distances when showing the underside (max. 1600 m ), or during visual perching (max. 2100 m ), or when reacting to prey (max. 1000 m on flying bird; see appendix H20 ). A preference for exposed sites in the landscape, as well as perching on elevated points, is also known from birds of prey, crows, and butterflies. By thermal soaring, birds of prey can advertise a 3 dimensional territory, even in country difficult to survey on the ground. In contrast, visual perching of Shrikes is only apt to advertise a 2 dimensional territory in semiopen landscapes. With visual high flights L. excubitor may enter the third dimension.
5. Structure of Habitats of the Great Grey Shrike in Traditionally Cultivated and Natural Landscapes
5.1 In the complete distribution range of the species, the general structural characteristics of the habitats of the Great Grey Shrike are similar; L. excubitor-habitats are semiopen landscapes with dispersed woody plants. Both in natural and in cultural landscapes, these habitats are characterized by few species from few genera of woody plants (species of conifers, wild fruit-trees and thornbushes). In the succession towards wood, the more open parts of a semiopen landscape could be used at first as winter-territories, and when stocked more densely as breeding-territories. This model is supported by the observed correlation between distances of woody plants and length of occupation period of a breeding-territory. In natural landscapes, habitats of the Great Grey Shrike are situated at "timber line-zones" in wooded ecosystems, or at "special sites with woody plants" in ecosystems otherwise free of woody plants. Habitats of the northern subspecies (e.g. L. exc. melanopterus, L. exc. sibiricus, L. exc. funereus, L. exc. mollis) may be found at clearings in the taiga-woods or in the transition zone from taiga to tundra; of the southern subspecies (e.g. L.[exc.] merid. elegans, L.[exc.] m. aucheri, L.[exc.] m. pallidirostris) at sites in steppe and desert, where accumulating water allows growth of woody plants.
5.2 As to L.e. excubitor in traditionally cultivated landscapes, 1/2 of the breeding-habitats are situated in tree-dominated landscapes (orchard trees, isolated other trees, open woods); reversely 4/5 of the winter-habitats are found in bush-dominated landscapes (isolated bushes, hedges; Fig.47). Such a seasonal shift in habitats, from tree dominated (breeding) to bush-dominated landscapes (winter), is discernible for many subspecies of L. excubitor and also for other Lanius-species. Only 5,9% of the breeding-habitats are historically new (e.g. conifer afforestations, barrage areas with afforestations, clay and gravel-pits). The central european subspecies L.e. excubitor may be considered as follower of civilization; most of the other subspecies are rather avoiding cultivated country. Reversely among other Lanius-species only few inhabit exclusively steppes, semi-deserts and deserts, and are thus strictly avoiding cultivated country. Special structures: Wooded landscapes function as habitat of the Great Grey Shrike only at borderlines in a broad sense (clearings, edges of woods), and mostly in connection with other habitats. Wet places are important parts of the habitat for most species of Shrikes. Artificial perches (e.g. posts, fences, poles, power lines) seem to be important only for few species, and less for L.e. excubitor, and their use depending on the supply of natural perches.
6. Microhabitat Structures and Edge-Effects: In cultivated as well as in natural landscapes, habitats of the Great Grey Shrike show similar characteristic small-scale structures, that develop through periodic extensive grazing or at wet places. Small-scale structural variety results from grasses respectively other plants growing in tussocks (Fig.48), from mounds built by ants and rodents (Fig.50), and from a mosaic of areas with variable density and height of plants and with tracking paths (Fig.58). This variety is caused by the feeding patterns of the grazing animals. Of crucial importance is the intensity of grazing: both when grazing is intensive and very extensive or absent, the tussock grasses (tuffocks) are displaced, and with them the microhabitat structures disappear. The structural variety in habitats of the Great Grey Shrike leads to 'effects of growth-density' in summer, so that there are always patches with sparse and low vegetation-cover. In winter this variety causes 'effects of snowlessness', so that certain points are prematurely free of snow (Fig.49-Fig.54). These effects seem to facilitate prey capture for the Great Grey Shrike, especially in extreme weather (heavy rain or deep snow). Small mammals, insects and spiders concentrate at the microhabitat structures (through edge-effects), partly even in winter. 'Effects of snowlessness' may be found in wooded lands too (Fig.56, Fig.57) and could be important for the survival of certain resident bird species there (e.g. owls, grouse).
7. Cultivation and Structure of Landscape in Habitats of the Great Grey Shrike: Habitats of the Great Grey Shrike in traditionally cultivated landscapes show spatial and temporary gaps between cultivation. In these gaps natural structures can develop. The semiopen structure of the country with dispersed woody-plants was formerly preserved on a long-term basis by secondary utilization of the woody plants, e.g. winning of firewood, foliage-hay, and fruit (in landscapes with hedges, bushy moorland or orchards). By way of contrast, intensive land-use nowadays leads to sharp borderlines of cultivation, so that mainly areas free of woody plants and uniform forests remain. A renewed overgrowing with wood of the habitats of the Great Grey Shrike was formerly prevented by rejuvenescence of the woody plants, through periodical cutting every 10-20 years; e.g. in moorland with bushes (here by burning too), heaths (cf. Fig.59), or in landscapes with hedges, naturally growing on mounds of stones picked-out from arable land ("Steinriegel", Fig.60) respectively planted as enclosures on earth mounds ("Wallhecken"). Reversely in landscapes with orchards, withering trees were replaced, e.g. in "orchard woods" in areas at a distance from villages (planted on former pastures on common ground; Fig.61), or in "orchard gardens" near villages (on smallest plots of private property; Fig.62). In the cultivated forests of today, open wooded landscapes suitable as habitats of the Great Grey Shrike can only be found at accidental, storm or fire damaged sites.
8. On the evolution of habitat selection in the Great Grey Shrike: The two groups of subspecies of the Great Grey Shrike in the northern respectively in the southern parts of its distribution range show a preference for two different types of habitats ('timber line-zones' respectively 'special sites with woody plants') and feed on two different groups of prey (endothermic respectively ectothermic animals). Furthermore subspecific differences in wing- shape may be explained in regard to differences in the degree of openness of the habitat. It is concluded that these differences in habitat and main prey have substantially contributed to the evolution of the two groups of subspecies, i.e. the two species L. excubitor s.str. and L. meridionalis s.l. A change from endothermic (in northern) to ectothermic prey (in southern populations) seems to occur also in other bird species with a broad dietary range. The classification as 'vertebrates' or 'invertebrates' mostly used so far seems to be less apt. Habitat selection in the Great Grey Shrike (and more general: in most Lanius species), i.e. the preference of semiopen landscapes, may have evolved as a result of displacement by dominant species of greater size, and as an adaptation to endangering from predators, to perch hunting and to territory advertisement by perching. Hence surveyability is an important characteristic of the Shrike's habitat. Within the northern group of subspecies of the Great Grey Shrike the seasonal shift of habitats may have evolved as an adaptation to the natural development of the vegetation, with woody plants growing denser and higher in successive stages.
9. Extinction of the Great Grey Shrike and Nature Conservation
9.1 The decline of Great Grey Shrike populations in Central Europe took place in two phases: following the disappearance from vast areas after about 1960, a second phase set in about 1975 when even districts which were still intact were given up. Recent increases seem to be restricted to small regions. In the region of the southwestern Schwäbische Alb, possible causes of decline in this second phase are connected with changes in habitat-structure: the sizes and the distances of woody plants have become too large ("tree-dominated landscape", upper limits for basal-areas and distances); the surveyability from perchs of the surrounding area is greatly diminished (by afforestations and increasing size of woody plants). In Central Europe possible causes of decline with long-term influence are: diminished breeding-success, in connection with food shortage and cold-wet spring weather; increasing distances to neighbouring territories (mean distance 2-3 km , upper limit at about 4-6 km ); too high respectively too dense vegetation, even in extensively cultivated areas (after laying fallow), making it harder to capture prey; displacement of the Great Grey Shrike in the developing tree-dominated landscapes by dominant species of greater size, which can even use perch-free areas, being less threatened by enemies; and disturbances by humans (being rather restricted to day-time), which could endanger the nest and diminish the hunting success.
9.2 Structural changes of semiopen and merely extensively cultivated landscapes are affecting many species of open landscapes, apart from the Great Grey Shrike. Hence the spatial structure of a landscape should be more taken into consideration in conservation work. In order to preserve still existing extensively cultivated areas as suitable excubitor-habitats, the following measures are suggested: at the edges of still intact areas, zones of 100-300 m width should be stocked with isolated woody plants (bushes, fruit-trees) at distances of 30-100 m (cf. Fig.63); hedge-rows and overgrown, tree-like hedges should be cut to smaller size again; as a result of hedge management, only exceptionally old or dense, thorny bushes (at most every 30-50 m ), and exceptionally old, poorly growing or partly dead trees or wild fruit-trees (at most every 50-70 m ) should be left (cf. Fig.64); land with low fertility in open country should no longer be afforested with conifers; in already existing afforestations straight lanes should be cut to increase survey capabilities; continuous nets of tarred farming-roads should be interrupted by sections of clay-and-grass ways, and still existing clay-and-grass ways should be retained with priority; new farming-tracks should be built only as parallel lines and not as nets; natural structures of woody plants (e.g. dense excresences) should be preserved, and accordingly in landscapes with traditional orchards only every third fruit-tree in turn should be pruned when cultivated; the ground-vegetation should be periodically cultivated preferably by extensive grazing or by mowing. Still existing, extensively cultivated larger areas should be preserved with priority, especially the former pastures on common ground in southern Germany, as examples of traditionally cultivated landscapes with an ecological potential that has grown at least over five centuries. Even extensively cultivated areas of small size that may not be valuable from a botanical view-point should be preserved when viewed as parts of a greater semiopen landscape and in regard to their importance for birds. A territory of the Great Grey Shrike represents an economical value of at least 200.000 - 800.000 Euros. The habitat requisites of the Great Grey Shrike are depicted schematically for landscapes with traditional orchards (Fig.65) and with hedges and heath (Fig.66).
1. Site, relative position and environment of nests of the Great Grey Shrike in the region of the southwestern Schwäbische Alb: Nests are found in similar proportions in each of 3 types of woody plants: in fruit-trees (respectively in deciduous trees in general), in conifers and in spinous bushes (Fig.1), in a mean height of 9,65 m ±1,99 m (range: 1,7 - 38,0 m , Fig.2), and at about 70% of the total height and in a distance of about 70% from the margin to the centre of the woody plant (Fig.3), and mostly at the inner margin of the foliage zone. Nests in conifers (mainly in habitats with hedges and heath) are situated mostly in a "top-center" position, nests in fruit-trees and in spinous bushes (mainly in habitats with traditional orchards) are in a lower and more marginally position (Fig.3). Nearest woody plants are found in a mean distance of M= 13,10 m and their twigs approach up to M= 6,29 m ; they mostly rise above nest level (M= +1,53 m ). Points used for 'visual perching' near the nest are located in a distance of M= 29,79 m and rise M= +4,28 m above nest level (Fig.6).
2. Microstructure of the nest site makes access to the nests difficult through more or less vertical sections of the stem or branches, often in connection with the space below the nest being more or less devoid of any branches, and through dense respectively spinous twigs of the woody plant as a whole. The nests are covered at least from above by foliage. The nest itself can be surrounded with dense, repelling twigs and is located mostly in concentrations of twigs ("basket") with several carrier and supporting twigs (Fig.4). A layer of spinous twigs can be part of the 'outer nest' (Fig.5).
3. The woody plants used for nesting are classified into five different types: fruit-trees, deciduous trees other than fruit-trees ("non fruit-trees"), conifer trees, spinous bushes, and bushes without spines ("non-spinous"). In other populations of Lanius e.excubitor in Central Europe these different types of woody plants are used in relative frequencies similar to those in the study area (Fig.1), with an often higher proportion of "non fruit-trees" and variations in the proportion of spinous bushes respectively conifers. Prior to 1900 nests in deciduous trees were more frequent, from 1900 on nesting in conifers has increased (cf. appendix N1). Compared to Central Europe, nests in conifers are more frequent in more northern populations and subspecies, in contrast nests in spinous bushes are frequent in southern subspecies of L. [exc.] meridionalis s.l. (cf. appendix N1, N2). In Central Europe Lanius senator and L. minor are tree-nesters to a higher degree than L.e. excubitor, and L. collurio is nearly exclusively bush-nester (Fig.7). In Central Europe the majority of Shrike nests are built in relatively few species of woody plants (L.e. excubitor: pine 20,0%, spruce 18,1%, pear 9,0%, oak 7,4%, blackthorn 6,8% of n= 957; L. senator: apple 30,7%, pear 21,6%, poplar 21,0% of n= 486; L. minor: pear 35,9%, apple 19,8%, poplar 10,9% of n= 359; L. collurio: wild rose 22,3%, blackthorn 17,9%, bramble 10,0%, hawthorn 8,1%, spruce 11,7% of n= 3290 ). In Central European populations of L.e. excubitor the nest heights are similar (accidental findings: x= 6,60 ±1,03 m, weighed average for all populations: x= 8,68 m ), often with a large range in a population. Nests of northern and southern subspecies are mostly located lower (weighed average for southern subspecies L. [exc.] merdidionalis s.l. x= 1,57 m ; Fig.8). Nest heights in L. senator and L. minor are comparable to L.e. excubitor, nests of L. collurio are mainly lower (Fig.8). A marked sequence of all four species exists according to weighed averages (minor: x= 6,42 m , senator: x= 4,95 m , collurio: x= 1,34 m ). A comparison of the nest heights over the distribution range of the Great Grey Shrike (Fig.8) shows that the habitats at the northern and at the southern border of the distribution range have a similar structure, concluding from heights of the woody plants used as nest sites. Therefore the two groups of subspecies of the Great Grey Shrike might have evolved in similar habitats, but under different climate.
4. Devices for nest defence are similar in many Lanius species: to the greatest possible extent nest sites are "inaccessible" from the ground, "impenetrable" from outside and inside of the woody plant, "invisible" from outside and from above; the microstructure of the nest site with concentrations of twigs is similar (cf. Fig.9). The importance of these devices for nest defence varies in the different types of woody plants used as nest sites. In the region of the southwestern Schwäbische Alb nests of L.e. excubitor get more or less "invisible" through cover of the nest-tree or -bush itself in fruit-trees and spinous bushes with their relatively broad crowns, and rather through surrounding trees in conifers with their smaller crowns. Nest sites of L.e. excubitor are located mostly in "top-margin" respectively "top-center" position, those of L. minor "top-center", those of L. senator in "middle-margin" respectively "low-margin", and those of L. collurio in "top-margin" respectively "middle-margin" position in the woody plant. In open-nesters optimal defences against aerial predators ("inside" as far as possible, repellent nest vicinity) and against ground predators (as "high up" as possible) and against weather (as "less exposed" as possible) are often mutually exclusive. If the microstructure of nest sites is taken into account, even in open-nesting species such as L.excubitor a shortage of nest sites seems probable.
5. Change between different types of woody plants used as nest sites: Mostly, the type of woody plant is not changed in successive breeding attempts of the Great Grey Shrike. Determining factors for a change could be seasonal changes in the availability of different nest defences or imprinting.
6. Reuse of nest sites: In the region of the southwestern Schwäbische Alb about 10% (15%) of the nests (respectively woody plants used for nesting) are used more than once, and about 30% of all breeding attempts take place in reused nest areas. In habitats with orchards a reuse is more frequent than in habitats with hedges and heath. Nests mostly consist of three layers: an often resistent 'outer nest' of coarse and partly spinous twigs, and with feathers and hairs; a middle layer of finer twigs, dry grass, rootlets, moss and animal and plant wool; and a lining with smaller feathers, hairs and wool. Mainly the layer of the 'outer nest' is resistent to weather for more than one year. In the year before reuse breeding success in reused nest areas seems to be higher compared to nest sites used only once, and losses that may have occured in the year before reuse are most often due to weather. Similarly in other populations of L.e. excubitor and in other Lanius species, only nest areas seem to be reused (cf. Tab.1) that were unpredated and successful in the past year. Reuse by L.e. excubitor is similar to the behaviour of smaller birds of prey or owls. Factors determining reuse of nest sites may be, besides breeding success, diminished expenditure for nest-building, changes in the environment of the nest and competition with other species, and thus a shortage of nest sites.
1. In habitats of the Great Grey Shrike Lanius e.excubitor, which is an endangered species in southern Central Europe, other species occur which are also threatened from extinction or are at least regionally rare. These include mostly 10 (up to 15) breeding species and 6 raptor species which hunt in excubitor-territories (Fig.1). In particular some are predators and food competitors of the Great Grey Shrike (Fig.1). The Great Grey Shrike can be regarded as an indicator (or "umbrella species") for semiopen, extensively cultivated landscapes.
2. In landscapes with open hedges the composition of this bird fauna depends on the age and condition of the hedges and the stone mounds ('Steinriegel') on which the hedges grow (Fig.2). In landscapes with traditional orchards the typical species use different parts of the fruit-trees as nest sites (Fig.3).
1. General Issues and Summary. Intra- and interspecific comparisons of breeding, population and habitat parameters in relation to latitude ( °N) are presented for four species of Central European Shrikes of the genus Lanius (L. collurio, L. excubitor, L. minor, L. senator). In Lanius excubitor both northern and southern group of subspecies are included here under the name of the superspecies "L. excubitor". - This semi-quantitative graphical method emphasizes the geographical variation of these characteristics. Thus generalizing conclusions, drawn from studies in restricted areas (e.g. Central Europe), can be checked for reliability on species level. From interspecific comparisons conclusions on life history traits may be drawn. Even non-quantitative older data (when only ranges are given) and accidental findings (compilation of data with small sample size) may be included. In this way changes of the parameters in the last two centuries are also detectable. - In the long-distance migrants L. collurio, L. senator and L. minor, clutch size is on average smaller and breeding success higher than in the partial migrant L. excubitor. This may reflect different adaptations to fluctuations in weather conditions and nest predation, or food supply. - In L. excubitor territory size is often smaller, and population density much higher in the southern group of subspecies compared to northern subspecies. In relation to body-weight, breeding-territories of L. collurio, L. collaris, L. sphenocercus are small, those of L. excubitor and northern populations of L. senator are large. Territory-size and population density may be adapted to effectively available food-supply. - In the tree-nesting species L. excubitor, L. senator, L. minor nest heights are similar, and larger than in bush-nesting L. collurio. Historical changes may reflect changes in habitat structure. - Contrasting to start of breeding, the end of the breeding season in L. excubitor varies only slightly. This seems to reflect the need of the young to hunt efficiently before onset of winter.
2. Clutch Size, Brood Size, and Breeding Success. C l u t c h s i z e : In Central Europe the clutches of the long-distance migrant species Lanius collurio, L. senator and L. minor are mostly smaller than the clutches of the resident respectively partial migrant species L. excubitor. Geographical variation of clutch size is strong in L. excubitor, but may be absent in the long-distance migrants (e.g. L. collurio). Differences between migrant and resident species seem to be weaker at lower latitudes (cf. 50 °N respectively 35 °N, for L. excubitor and L. senator). Clutch size seems to vary with h a b i t a t : clutches are larger in habitats with orchards or in steppe and semideserts (in L. excubitor, L. senator, L. minor), and clutches are smaller in habitats with hedges and heath or with mires (in L. excubitor). - B r o o d s i z e : In contrast to clutch size, brood size (number of young in successful broods) shows no clear trend with latitude, and varies strongly between local populations. In the long-distance migrant species Lanius collurio, L. senator and L. minor brood size is often equal to the resident species L. excubitor. - B r e e d i n g s u c c e s s a n d a d a p t a t i o n s : In the Central European l o n g - d i s t a n c e m i g r a n t species, with smaller clutches and often larger broods, breeding success is on average higher than in the resident respectively p a r t i a l m i g r a n t species L. e. excubitor. Variations in clutch size and brood size may be adapted to fluctuations in food supply, weather conditions and nest predation. Larger clutches may be adaptive in situations with strong variation of food supply ("brood reduction"), smaller clutches in situations with high losses caused by predation and adverse weather ("brood survival").
3. Territory Size, Population Density, and Body Size. T e r r i t o r y S i z e : Breeding and winter-territories of Lanius excubitor are largest in northern subspecies (70-60 °N), and smallest in southern subspecies (40-30 °N), with strong overlapping over large parts of the distribution range. At least in Central Europe, breeding-territories of L. e. excubitor (frequently 20-50 ha ) are smaller than winter-territories (frequently 50 - 90 ha ). In the northern and southern group of subspecies of L. excubitor, differences in territory-size may be connected to differences in d i e t a r y r a n g e (ectothermic, respectively endothermic prey) and in prey densities. - P o p u l a t i o n d e n s i t y : In the southern group of subspecies of Lanius excubitor breeding and winter density can be considerably higher than in northern subspecies. In Central Europe (53 - 47 °N) breeding densities (mostly 5 - 10 pairs per 100 km² ) and winter densities (mostly 5 - 11 birds per 100 km² ) seem to be similar (relation of densities approximately 1 : 1 ). Therefore in breeding areas the number of birds during winter is only about 50% of the number of adult birds during breeding season. Even though the population can be larger in winter, because L. excubitor also occupies non-breeding areas. It may be concluded that the Central European subspecies L. e. excubitor is a p a r t i a l m i g r a n t , with most young and many adults (more females than males) leaving in winter. - T e r r i t o r y s i z e a n d b o d y m a s s : For Lanius species that breed in single pairs, the correlation between body-size and territory-size (respectively home-range size) is n o t linear. When compared to the average "carnivore" passerine (regression line), and in relation to body-weight, the breeding-territories of Lanius collurio, L. collaris and L. sphenocercus are rather too small, those of L. excubitor and northern populations of L. senator are rather too large. Territory-size and population density depend strongly on the effectively available food-supply. Species with "rare" prey or a higher basic metabolic rate should have larger territories respectively lower population densities.
4. Nest Heights, and Habitat Structure. In Lanius excubitor, L. senator and L. minor nest heights are similar, nests of L. collurio are situated mainly lower. The former three species are t r e e - n e s t e r s , L. collurio is almost exclusively a b u s h n e s t e r . - Nest heights depend on the types of woody plants used for nesting, and thus may reflect h a b i t a t s t r u c t u r e . In L. excubitor, nests of the most northern (70 °N) and of southern populations (40 - 15 °N) are located in similar heights, and mostly lower than in Central Europe (53 - 47 °N). It may be concluded that the habitats at the northern and southern borders of the distribution range of L. excubitor show a similar degree of "openness". This is supported by qualitative habitat descriptions. - In Central Europe nest heights often show a large r a n g e within a population (total range for L. e. excubitor: 0 m - 38 m ). Formerly (100-150 years ago) nests of L. e. excubitor apparently were located lower, while nests of L. senator and L. minor often were located higher. This may reflect the c h a n g e s in semiopen habitats in the whole of Central Europe: from bush-dominated to tree-dominated landscapes, and may be connected with changes of the tree species mainly cultivated in forestry: from deciduous trees (mainly oak Quercus) to conifers (mainly spruce Picea), and an elongation of the cycles of cultivation.
5. Breeding Season. In Lanius excubitor, the s t a r t of the breeding season depends on latitude and is delayed for approximately 30 d per 10° northward. On the contrary the e n d of the breeding season varies to a lesser degree (25°N - 70 °N: about 30 d ). The end of the breeding season may be determined by the decline of food supply at the onset of winter. The young need a certain time for gaining enough skill to hunt efficiently. - The l e n g t h of the breeding season seems to be adapted rather to the seasonal variation of temperature in northern populations, and to local variations of humidity (respectively periods with dry spells) in southern populations of L. excubitor.
In the semi-open landscape inhabited by Great Grey Shrikes (L. excubitor) in southwestern Germany, bushes and trees occur at a mean distance of 35 m (about 5 per ha) and have a mean basal area of 30 m² each. A permanent excubitor territory with a size of about 68 ha comprises about 600 woody plants. Sites for nesting, caching, and roosting are situated near hilltops or upper edges of slopes. Shrikes use survey-points regularly for visual contact. In different habitats dispersion of bushes and trees is similar. Upper limits for bushes and trees are at mean distances of 50-60 m, and mean basal areas of 40 m². A seasonal habitat shift occurs.
Errata in the printed version of the paper: (1) Throughout the paper, basal-areas should be given as square meters ( m² ), and not as cover ( not: m²/ha ). Basal-areas give the size of the "footprint" area of the woody plant, i.e. in top-view, from above; the area covered by all the branches up to the outermost ends of branches (for examples, see Ökol. Vögel 16, 1994: p.348, 350, 406, 408).
(2) Fig.11, p.146: GJ = permanent territory (instead of: P = ...); NurW = territory used only in winter (instead of: Only W = ...).
In the Great Grey Shrike (Lanius excubitor) in southwestern Germany, contacts between single individuals, as well as "group-meetings" (of on average 4 individuals) are more frequent before and after the phase of the annual cycle when birds are in pairs. At pair-formation, dominance changes from individuals being dominant in their individual territories to male dominance over female, and females change from self-feeding to feeding by the male. Potential nest-sites are indicated by four nest-displays, with the earliest occurence at 37 days before start of nest-building. During close encounters of females and males three displays are used. The total breeding cycle, from start of nest-building to independence of young, takes on average 55 days. Families dissolve in several steps: young fledge at ages of 20-21 days, broods divide at age of 30 days, and departure from breeding territory of first to last young or adults occurs 40-60 days post-hatching. Partners of successful pairs depart separately. Unsuccessful pairs depart either jointly or as single birds. As far as is known, all subspecies of L. excubitor are only paired for one season. Seasonal pair-bond could have evolved from ancestors with communal breeding, caused by lower prey density and seasonal food-shortage.
Shrikes (Lanius) are known for similarities to raptors in several morphological and behavioural aspects (cf. Table 3), e.g. the shape of the bill with hook and tomial tooth (Fig.1, Fig.2); the slightly protruding position of the eyes facilitating binocular vision (Fig.3); and, compared to cursorial passerines, the relatively strong feet with large distal digital pads (Fig.5); the killing of vertebrate prey by damaging the neck region; frequently used hunting techniques, e.g. hunting by perching, hovering, flushing; the "mantling" behaviour for shielding prey from conspecifics; the repeated use of the same sites for dismembering larger prey; and the regurgitation of pellets (Fig.6). Shrikes differ from raptors in characteristics related to the handling of prey: the capture of prey (with beak in shrikes, and with feet in raptors); the part of the body used to kill prey (with beak only, and mainly with feet); the mode of dismembering larger prey (fixed to a woody plant, and holding with feet); and the storing of prey (in a cache in shrikes, and mainly in the crop in birds of prey, respectively).
Less known similarities of shrikes to raptors are connected with territorial behaviour (visual perching; Fig.7); and with breeding (relatively large, persisting nests, and partial re-use of nest sites, Table 1). Shrikes differ from raptors with respect to other aspects of territorial behaviour (advertising by perching or at most by visual high flights in shrikes, Fig.7, and also by soaring in raptors); and in the duration of dependence of the young (with a relatively longer post-fledging period in shrikes, and probably an elongated nestling period too; Fig.8, Fig.9).
In relation to size and compared to raptors, at least the large species of shrikes seem to be highly energy consuming (Table 2). The interspecific relationships often show a dominance of raptors over shrikes, mostly related to differences in size (Fig.10). Thus, through displacement and endangering of shrikes, as a result of competition with raptors, shrikes might be restricted to semiopen habitats, with a good surveyability near the ground.
Erratum on p.194: In the top line of the paragraph, the ratio should be written in reversed order correctly as "( 'post-fledging' : 'pre-fledging period' )".
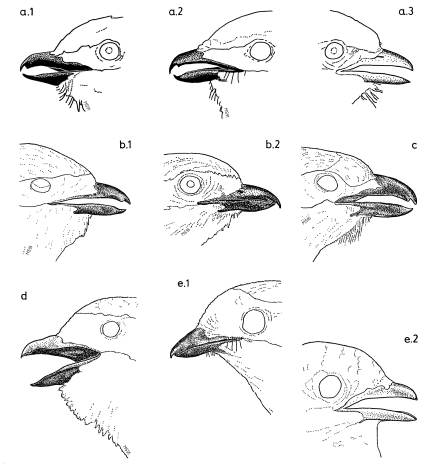
Fig.1 Bill of shrikes Lanius: with hook and tomial tooth in the upper maxilla and a corresponding concavity (indentation) in the lower mandible; in full-grown birds: with bill open ( a.1, a.2, b.1, c, d ) and with bill closed ( b.2, e.1, f, g, h ); in nearly fledged young birds: structures not fully grown ( a.3, e.2, i ). a) Great Grey Shrike Lanius e. excubitor, b) Red-backed Shrike L. collurio, c) Lesser Grey Shrike L. minor, d) Grey-backed Fiscal L. excubitoroides, e) Woodchat Shrike L. senator, f) Masked Shrike L. nubicus, g) Bay-backed Shrike L. vittatus, h) Long-tailed Shrike L. schach, i) Bull-headed Shrike L. bucephalus. Sligthly modified from photos of living birds, or from photos of freshly dead birds conserved by deep-freezing (only b.1, c ); for detailed references, see Ecol.Birds 18, 1996: 177.
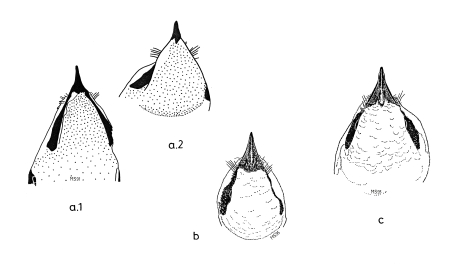
Fig.2 Shape of head and bill of shrikes Lanius, in top view: bill distinctly narrowing towards the tip, tomial tooth slightly protruding laterally and thus projecting over the mandible (see c ); a.1), a.2) Great Grey Shrike Lanius e. excubitor, b) Red-backed Shrike L. collurio, c) Lesser Grey Shrike L. minor. Sligthly modified from photos of living birds ( a ), or from photos of freshly dead birds conserved by deep-freezing ( b , c ); for detailed references, cf. Fig.1.

Fig.3 Position of the eyes in shrikes Lanius: eyes slightly protruding, adjacent areas being slightly depressed ( a.1, a.2, b ), enlargement of the field with binocular vision ( a.3, b ). a) Great Grey Shrike Lanius e. excubitor, b) Woodchat Shrike L. senator; for comparison: c) Eurasian Sparrowhawk Accipiter nisus. Modified from photos of living birds ( a, c from Schön 1994, b after Ullrich 1971).
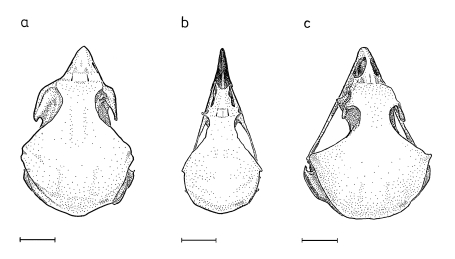
Fig.4 Shape of the skull of a shrike Lanius ( b ), compared with diurnal ( a ) and nocturnal ( c ) raptors, in top view: marked differences in the outline despite similar length of the skull; skull distinctly broadened posteriorly, with large inter-eye distance and large orbital cavities in raptors; skull rather slender of the passerine type in shrikes. a) Eurasian Kestrel Falco tinnunculus, b) Great Grey Shrike Lanius e. excubitor: tip of bill still with parts of the horny layer, c) Little Owl Athene noctua. Scale: line = 10 mm, ratio of size according to original sizes, with a slightly differing direction of view at the left and right margin (slightly oblique top-view). From a photo of specimen (Zool. Coll. Univ. Tübingen).
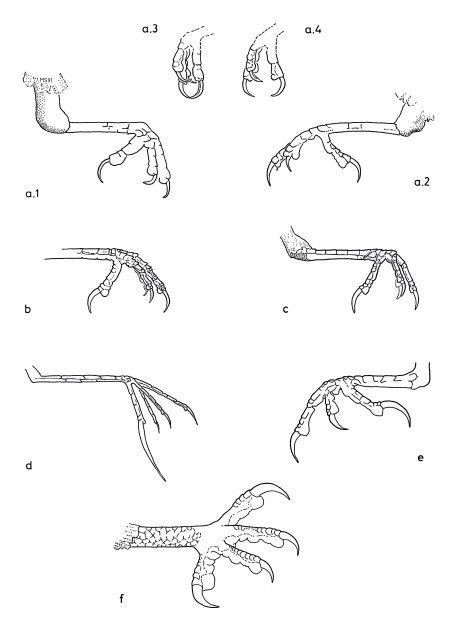
Fig.5 Foot of shrikes Lanius: 'gripping tongs' of the middle forward-directed toe and the backward-directed toe ( a.3, a.4 ), supported by lateral front toes and by large digital pads of distal claw phalanges ( a.1, a.2, b ), enhancing the effectiveness of the grip; a) Great Grey Shrike Lanius e. excubitor, b) Red-backed Shrike L. collurio, c) Lesser Grey Shrike L. minor; for comparison: slimmer foot of the Woodlark Lullula arborea ( d ), 'clipping-gripping foot' of about same diameter of Common Crossbill Loxia curvirostra ( e ), and much stronger 'gripping-killing foot' of Common Buzzard Buteo buteo ( f ). Slightly modified from photos of living birds ( a, b ), freshly dead birds conserved by deep-freezing ( c ), and museum specimen ( d, e, f ), drawn to approximately same length of tarsometatarsus respectively backward-directed toe.

Fig.6 Comparison of pellets of a shrike Lanius with small-sized diurnal and nocturnal raptors: pellets of similar shape and size, but with slightly differing diameter, in species with marked differences in body size; left: Eurasian Kestrel Falco tinnunculus, center: Great Grey Shrike Lanius e. excubitor, right: Little Owl Athene noctua. Scale: line = 10 mm. From samples collected in SW-Germany in winter and spring (grey colour resulting from high proportion of hairs of small mammals).
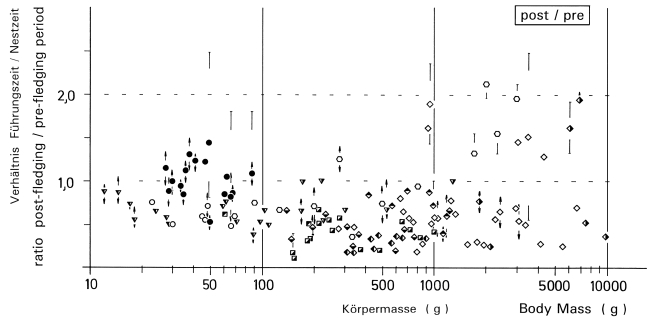
Fig.8 Ratio of 'post-fledging period' to 'pre-fledging period' in shrikes Lanius, in comparison with other passerines, and with birds of prey and owls, and in relation to body mass (in g , logarithmic scale): relative duration of the 'post-fledging period' in relation to the 'pre-fledging period' ( = 'incubation period' + 'nestling period'). Symbols: ↕ vertical lines with arrows = range of mean with most frequent sizes; ⎹ vertical thin line = range of values; ● ○ circles = true shrikes Lanius, with mostly several means shown for each species (see below), ● filled circles = large samples, ○ open circles = small sample; ▼ triangles = other passerines (except Lanius ), ⧨ triangle with filled left half = open-nesting passerines of similar size as shrikes (finches Fringillidae, warblers Sylviidae, thrushes Turdidae, buntings Emberizidae), ⧩ triangle with filled right half = corvids Corvidae (including hole- and niche-nesters); ◇ rhombus = diurnal raptors of the hawk-eagle family Accipitridae, ⬘ rhombus with upper half filled = buzzards Buteo, ⬙ rhombus with lower half filled = hawks Accipiter, ⬖ rhombus with left half filled = harriers Circus, ⬗ rhombus with right half filled = vultures Aegypius, Gyps, Neophron, etc., ◇ open rhombus = other Accipitridae, e.g. eagles Aquila, Circaetus, Haliaetus, Hieraaetus, Honey Buzzard Pernis; □ squares = diurnal raptors of the falcon family Falconidae, ◩ squares with upper left half filled = falconets Polihierax, Micrastur, ◪ squares with lower right half filled = true falcons Falco; ⎔ hexagons = owls Striges (Eurasian genera Asio, Athene, Bubo, Glaucidium, Nyctea, Otus, Strix, Tyto). Data: Lanius: 8 species, with several means from different populations of a species (L. nubicus 1, L. collurio 4, L. senator 3, L. collaris 2, L. minor 3, L. ludovicianus 3, L. excubitor S- 2, N-group 2, L. sphenocercus 1 mean value-s); other groups: only one mean for each species; for list of species, see Ecol. Birds 18, 1996: 208 (Appendix 8); for detailed references, see Ecol. Birds 18, 1996: 193; Ecol.Birds 16, 1994: 129.
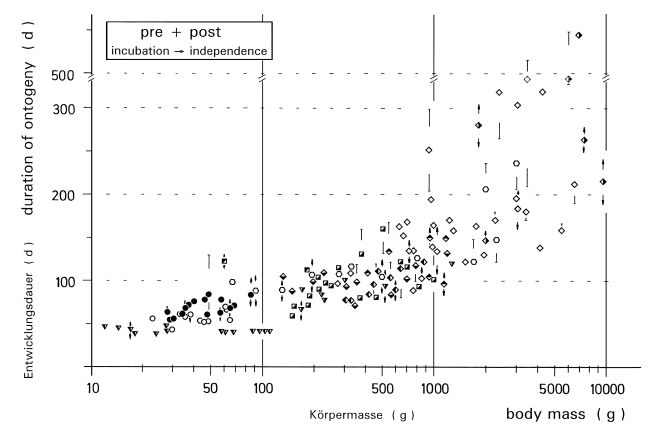
Fig.9 Duration of ontogeny ( days ) in shrikes Lanius, in comparison with other passerines, and with birds of prey and owls, and in relation to body mass (in g , logarithmic scale): time from the start of incubation of the eggs to independence of the young, i.e. total of 'incubation period' + 'nestling period' + 'post-fledging period'. Data: Lanius: 8 species, with several means from different populations of a species; other groups: only one mean for each species. Symbols, list of species, and references same as in Fig.8.
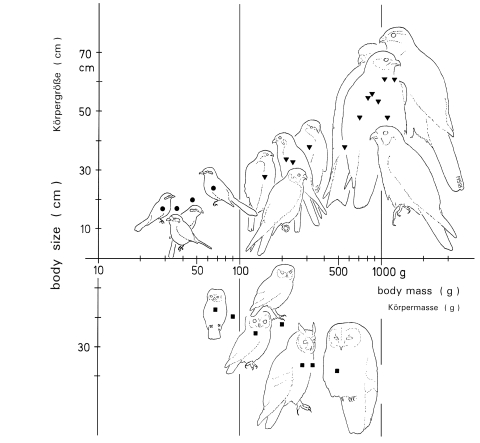
Fig.10 Comparison of body size ( cm ) and body mass ( g ) of shrikes Lanius, and of raptors ocurring in shrike habitats in Europe; outlines of the birds drawn to approximately same scale. Symbols = mean of size and body mass (logarithmic scale for body mass); ● circles = shrikes Lanius, ▼ triangles = diurnal raptors Accipitres and Falcones, ■ squares = owls Striges; only most frequent species shown: shrikes and diurnal raptors above, owls below horizontal axis; outlines modified from sketches in various field guides. List of species ( * outline shown), in order of sequence from left to right: ● shrikes: *Lanius collurio, *L. senator, *L. minor, *L. excubitor; ▼ diurnal raptors: *Accipiter nisus ♂, *Falco tinnunculus, *F. subbuteo, *A. nisus ♀, F. peregrinus ♂, A. gentilis ♂, Pernis apivorus, *Milvus migrans, *Buteo buteo, M. milvus, *F. peregrinus ♀, *A. gentilis ♀; ■ owls: *Glaucidium passerinum, Otus scops, *Aegolius funereus, *Athene noctua, *Asio otus, Tyto alba, *Strix aluco.
The wing- and tail-feathers of a breeding Great Grey Shrike Lanius e.excubitor found plucked by a predatory bird show clear male-type features (following Schön 1994a; cf. Fig.1, Fig.2): - extensive white base to secondaries and primaries (forming a broad wing bar), - broad pale margins to the inner webs of the secondaries (prominent connection between wing-bar and white trailing edge), - prominent white margins on the outer webs of the inner secondaries, - prominent white tips of the secondaries (broad white "speculum of the tips" in closed wing), - and a large amount of white on the outer rectrices. The determination of the sex as a male is reinforced by the observed differences in behaviour of the breeding birds, together with the pattern of a moulted feather from the surviving partner.
From a literature survey, it is concluded that the two groups of subspecies of Great Grey Shrikes in the northern and the southern parts of the distribution range (i.e. Lanius excubitor sensu stricto, and L. meridionalis sensu lato) show a preference for different types of habitats ("timber line zones" in wooded landscapes vs. "special sites with woody plants" in landscapes otherwise free of woody plants), and for feeding on different groups of prey (endothermic vs. ectothermic animals). The proportion of endothermic prey in the diet is about 90% in northern subspecies and 30% in southern subspecies.
The evolution of the Great Grey Shrike groups may have occurred under two different climate regimes (humid-cold, and dry-hot areas). Thus, the splitting into a northern and a southern group of subspecies could have occurred by adaptation to different types of natural habitats, with different seasons of food-shortage (winter vs. summer), and to different groups of prey. Morphological differences of the two groups of subspecies may also be explained in regard to these adaptations. Thus, wing shape may be linked to openness of habitat, and length of the leg to the agility and dangerousness of the main prey group. It seems that an "ecological classification" of prey according to seasonal activity patterns is more useful than the typological classification of "vertebrates" or "invertebrates" mostly used in diet analysis.
In Central Europe, the Great Grey Shrike occurs mainly in semiopen, extensively cultivated landscapes. These habitats were formerly maintained by traditional land-use practices. In gaps between cultivation, woody plants could grow naturally, and were cut down periodically. Thus, the semiopen structure of the country was preserved. In contrast, todays intensive land-use practices lead to sharp borderlines of cultivation, such that areas completely free of woody plants and uniform forests predominate. For conservation purposes, the spatial structure of the landscape should be considered, and the traditional micro-structures be preserved, or analogous structures should be produced by management. Spatial distribution of habitats was considered, when conservation measures were implemented in the study area. Management was extended from the core to the peripherial areas, where even small semiopen patches were included.
In hedge and heath habitats, three measures were considered crucial and were implemented: (1) former heaths overgrown by woody species were opened up, by thinning dense tree stands; (2) old tree-like hedges, that grew naturally on stone mounds ("Steinriegel") were rejuvenated by cutting stems; and (3) mounds of stones were constructed. Following these measures, a habitat not used in the past 15 years was colonized, and a deforested part of another habitat was resettled.
Errata: (1) On p.68: Abstract. - 4th and 5th line: "In contrast, ..., such that areas completely free of woody plants and uniform forests predominate." (instead of: "... areas of woody plants"). (2) On p.72, left column, center of the page: "Thereby, traditional practice leads to a reversion of the natural sizing of the stones of the mound ..." (instead of "sizes in the stones" ).
The two groups of subspecies in the Great Grey Shrike superspecies (northern group Lanius excubitor sensu stricto and southern group L. meridionalis sensu lato) show differences in ecology (habitats, prey) and social behaviour (territory size, density) (Table 1). Morphological differences are found in plumage pattern (secondaries, juvenile plumage), and with regard to shape of wing and tail, length of tarsometatarsus, and body size (Table 1). Morphological and ecological differences may be interrelated. Thus, shape of wing (and tail) may be related to habitat structure, and length of leg and graduation of tail to type of prey.
The evolution of the two groups of subspecies may have taken place under two different climates, and in connection with adaptations to differing habitats, seasons of food-shortage and prey groups (Table 2). The parapatry of the two species respectively groups of subspecies may be caused by a zonal limit and a geographically abrupt change of potential habitats, or by interspecific competition, or by both. The clinal geographic variation in morphology of wing and tail shape among each group of subspecies may be linked to alterations in climate, i.e. to decreasing distance from oceans at the western and eastern periphery of the distribution area. When relating morphological and ecological characteristics by a functional approach, it becomes evident that not only "derived" (apomorphic) but also "primitive" (plesiomorphic) characters should be beneficial to its bearers under specific ecological conditions.
In semi-open landscapes with juniper-heath, in each of the stages of the succession of the heath vegetation different species of birds are dominating, dependent on the size and the distribution of bushes and trees (Fig.22). In addition to being determined by the surveyability of the landscape as a whole, the composition of species is also influenced by small-scaled variation of the intensity of grazing, and by the occurence of characteristic micro-habitat structures of tussocks and mounds built by ants. Woodlark Lullula arborea and Great Grey Shrike Lanius excubitor may be considered as ecological indicators (umbrella species) for landscapes with open heath (Fig.22), being grazed in a traditional way by sheeps with a shepherd, covered by low and gappy ground vegetation with stony patches of pioneer stages, and characterized by high surveyability. The plant communites are also changing linked to the progression of the succession of heath vegetation: starting with xerothermic vegetation ("stony pasturage") and poor soil vegetation, followed by small isolated bushes and open hedges, and ending up with naturally grown wood of pines and spruces.
Pioneer stages, and hence also species depending on these, have become rare, because grazing was given up, and heaths became overgrown with natural wood. Thus, nature conservation for birds of heaths should give priority to the advancement of pioneer stages of the succession of heath vegetation. This could be achieved by opening of dense heaths overgrown with bushes, and by clearing (re-opening) of naturally grown woods, by strongly diminishing tree-like structures, and by grazing intensively patches with thin soil and stony ground, and by laying out of small strips of arable field for folding.
The composition of the bird community of landscapes with traditional mounds of stones and hedges varies according to the distribution of woody plants, i.e. bushes and trees, and to surveyability. Landscapes with different stages of the succession of vegetation, starting with freshly thrown-up mounds of stones and ending up with the wood-like strips of tree-dominated hedges, are inhabited by different characteristic species of birds (Fig.377). The Wheatear Oenanthe oenanthe may be taken as an ecological indicator (umbrella species) for landscapes dominated by pioneer stages of the succession of the vegetation of mounds of stones, while in climax stages with tree-dominated hedges rather common species of "woodland edges" may also be found (Fig.377). Similarly, the plant communities are alternating with the different stages of the succession of the vegetation: from xerothermic species of the pioneer stages to woodland species of the climax stages.
The former "labile equilibrium" of bush-like and tree-like structures in the landscapes with open hedges on mounds of stones has been shifting towards a dominance of tree-like structures when traditional cultivation practices were gradually vanishing. Correspondingly, the species characteristic for pioneer stages of the succession of vegetation have also declined. Therefore, the priority aim for conservation of bird species of mounds of stones and open hedges should be the advancement of pioneer stages of the succession of vegetation of these mounds. This could be achieved by rejuvenescence of hedges, where tree-like structures should be diminished strongly, by construction of artificial mounds of stones mimicking the traditional model, and by planting of single well-dispersed bushes or small hedges in areas free of such structures.
Micro-structures in arable fields are apparently of great importance for the Skylark, a species which has declined over vast areas of Europe. In two study areas (U1, U2) in SW-Germany, in early summer the Skylark showed a preference for arable fields with low emergent crops, with 88% (58%) of the territories on 35% (33%) of the total area of U1 (U2), and with 3.0 - 3.8 (4.1 - 4.3) territories per 10 ha. The distribution of Skylark territories showed a strong preference for "places with stunted growth" caused by traditional cultivation practices (clumping of abrupt changes in the direction of the edges of plots, shallow depressions along the longer margins of plots with elevated central parts, i.e. furrow and ridge), or by microtopographical-geological conditions (doline over karst, wet or stony places); and a marked avoidance of arbitrary places anywhere in the fields. On the other hand, places with stunted growth caused by modern cultivation (edges of stands, clay- or grass-covered country-lanes) were used less frequently than expected (Fig.1). The preferred places with stunted growth often originated around edges of plots in traditional small-scale cultivation, but are nowadays mostly situated within actual stands, the former edges having been tilled over. With respect to conservation, preferred places like these should be evenly dispersed over the arable fields, thus building up a mosaic of micro-structures.
1. Changes of semi-open landscapes. In many species of semi-open habitats, and especially in cultivated land, a strong population decline has taken place in the last decades, e.g. in Whinchat, Woodlark, Great Grey Shrike. With Lanius excubitor habitats taken as an example for semi-open landscapes, the following causes of decline may be deduced: intensification of land-use, expansion of settlements, and more atlantic climate with more cool-wet springs being largely responsible for disappearance from vast areas; and changes in the structure of landscapes responsible for the continuing decline even in still intact habitats, with: increasing overall distances between woody plants (but an increasing density on land no longer cultivated) and increasing size of woody plants, decrease in surveyability, separation of habitats, increasing density and height of the ground vegetation, and increasing disturbances by humans; in connection with: disappearance of dispersed trees and bushes, fields no longer cultivated becoming overgrown with natural wood, and change of hedge-dominated into tree-dominated landscapes (Table 1). The distribution of ("well-dispersed") woody plants is of great importance for perch-hunting species (Fig.1).
2. Aims for conservation. Proceeding from studies in the region of the southwestern Schwäbische Alb, the following general aims for conservation of semi-open landscapes are developped (Table 2): preservation and restoration of the surveyability and semi-open structure of the landscape, conservation and mimicking of traditional extensive cultivation practices, preservation of areas with few disturbances; and the following guide-lines for management (Table 2): ecological management of woody plants, construction of micro-structures with advancement of pioneer stages, and ecological cultivation of patches of land in high-intensity areas.
3. Management measures. These conservation aims may be approached with the implementation of the following measures for restoration and conservation (Table 3): (1) ecological management of woody plants, adapted to the various types of landscapes, whereby rather low hedge-like structures should be advanced and tree-like structures removed, and weakly growing woody plants and concentrations of twigs, i.e. parts with stunted growth, should be preserved (Table 4); in detail: hedgerow management (Fig.3) with rejuvenescence of tree-dominated superannuated hedges, heath management (Fig.6) with clearing (re-opening) of natural woods and of dense heaths, management of traditional orchards (Fig.11) with pruning of trees in alternating groups of trees and preservation of old withering fruit-trees, management for moorland with clearing of natural birch-alder-wood in fens; (2) construction of micro-structures that mimic the traditional model, e.g. artificial mounds of stones (Fig.13, Fig.14) situated at places easy to survey and constructed out of rough soil-free stone material with a cap of larger stones and a rounded shape of the mound, and planting of single well-dispersed trees or bushes (cf. Fig.1) with low-growing woody species; (3) low-intensity extensive grazing, e.g. grazing by sheep with a shepherd, and a ploughed field for folding; and low-intensity use of meadows, e.g. by multi-strip mowing (Fig.19) with alternating fallow strips. - Even shortly after implementation of these management measures in the region of the SW-Alb, the first success may be recorded. Until now, ecological management of woody plants took place at a total of 14 sites in an area of > 60 ha, and in addition 90 stone mounds were constructed (Table 5). The implementation areas were used by Great Grey Shrikes either continuously or reoccupied or even colonized, as well as being quickly accepted by various other bird species of semi-open habitats (Table 6); and the artificial stone mounds were used by at least 22 species (Table 7).
4. Situation and conservation of landscapes. Based on observations at sites used for many years by species of semi-open habitats, the conservation concept proposed here attempts to deduce guide-lines for preservation and management of semi-open landscapes, their micro-structures, and plant and animal communities. The priority of various conservation measures should be set according to the situation of a landscape: in more open, hedge-dominated landscapes the management of grassland may be sufficient, while in denser, tree-dominated landscapes the management of woody plants may be more important. An ecologically orientated, extensive use of grassland should be characterized by short-grassed, partly uncovered areas alternating on a small-scale level with areas with long-grassed, denser ground vegetation. In (semi-) open landscapes, this may be achieved in grassland by successive mowing of strips, or in pastures by weak grazing (also of woods).
5. Microhabitat structures in arable land. Micro-structures may also be found in open arable land, originating from gaps in cultivation in traditional land-use practices, e.g. places with stunted growth in shallow depressions along the margins of traditional land plots with ridge-and-furrow, at traditional field paths, at marginal plots, over dolines, or in stony areas (Fig.21, Fig.22). Equivalents of such microhabitat structures could be constructed for ecological purposes: by ecologically orientated arable land-use of small patches (Fig.23), with small-scale and short-term ploughing of alternating strips of land; and by ecologically orientated arable land-use of small patches at wet, soggy places (Fig.24), with artificially compressed soil and largely uncovered, bare ground. The distribution of such micro-structures is important for bird species of open arable land. Thus, the breeding places (territory centers) of Skylark Alauda arvensis and Common Quail Coturnix coturnix are often situated near such 'places with stunted growth' (Fig.21, Fig.22). - Patches of arable land with alternating cultivation of diverse crops and with uncovered bare ground may be rewarding foraging sites for Shrikes Lanius, Little Owl Athene noctua, Hoopoe Upupa epops (Fig.23).
6. Gaps in cultivation, and pioneer stages. Semi-open landscapes are characterized by a "labile equilibrium" of bush-like and tree-like structures which in traditionally cultivated landscapes was formerly maintained in an apparent steady state by secondary use of woody plants (coppicing for firewood etc.). The woody plants could come up in gaps in cultivation that remained largely undisturbed (apart from secondary use) and could develop microhabitat structures autonomously ("running wild"), and that are a characteristic of traditional small-scale and extensive cultivation practices (Table 8). By way of contrast, in modern high-intensity cultivation the semi-open transition zones are replaced by sharp borderlines between wood and field. Because the secondary use of woody plants has stopped, the labile equilibrium of woody plants is shifted towards a dominance of tree-like structures, and the pioneer stages of the succession of vegetation have become rare. Accordingly, the animal species characteristic for pioneer stages in semi-open landscapes have declined too (open hedges: Fig.25, heath: Fig.26).
7. Conservation of a district. In large-scale conservation of semi-open landscapes, parts with open field and with wood, respectively the rests of traditional cultural landscape and natural landscape should be included, in a conservation concept for the district as a whole. Peculiarities of the region of the southwestern Schwäbische Alb facilitating conservation are: the wide-spread natural pine-spruce forests (plateau, Fig.27), extended traditional orchards (foreland of the Alb), and extended areas of ridge-and-furrow land, the preserved semi-open structure of rounded hilltops and margins of valleys, and the relatively large total area of semi-open parts. Thus, a conservation concept for the district of the SW-Alb should include the semi-open habitats of the Great Grey Shrike in the field, with landscapes with heath, hedges on traditional stone mounds, and traditional orchards; and the semi-open woodland habitats of the Hazel Grouse Bonasa bonasia, with woods on steep slopes at the terrace and along valleys of the northern margin of the Alb. In these habitats, many additional endangered species of animals and plants occur.
8. Models of traditional practices. Being guided in the construction of microhabitat structures by the models of traditional practices, the construction of artificial mounds of stones should take place at exposed places (stony ground, transport of soil into the interstices diminished), near arable land, and with large superficial interstices between stones. Thereby, the reversion of the natural sizing of the stones, which comes up casually in traditional practice by picking up the largest stones from a ploughed field, can only be achieved by an additional effort in artificial stone mounds (by deposition of a cap of large stones; cf. Fig.14). As a result, the utilization by species of semi-open habitats is facilitated, through the exact and often laborious mimicking of traditional micro-structures (as reliable models), e.g. for the Wheatear O. oenanthe (breeding at sites which are easy to survey, in large interstices, and foraging at partly uncovered, short-grassed places).
9. Dynamics of vegetation. In Central Europe, the structure of semi-open landscapes in cultural land mostly may be maintained in an apparent steady state only artificially. Here changes take place mainly in gaps in cultivation, in the form of partial successions of the vegetation. Only the mosaic of these partial successions which has to be renewed periodically constitutes an ecologically valuable habitat (cf. Fig.25, Fig.26). In addition, an autonomous dynamic development starting from the actual situation of the landscapes would start under deeply disturbed conditions compared to any natural situation (e.g. with animal and plant species being not indigenous, and with few species occurring in very large numbers). In the present situation, especially the pioneer stages are shortened and rare, and thus should be advanced.
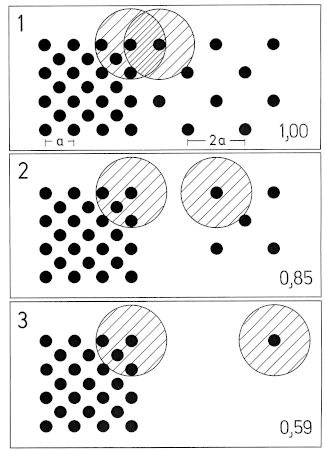
Fig.1 On the significance of dispersed isolated woody-plants: distribution of perches and usable area for the Great Grey Shrike and other bird species hunting from perches; three stages during the change of a semi-open model-landscape (top-view); left half of sections: 25 woody perches in a denser stand in distances of a ; right half of sections: phase 1: +10, phase 2: +5, phase 3: +1 scattered isolated woody perch(es) in distances of 2a ; numbers: ratio of usable part of the total area (phase 1 = 100%); black dots = woody plants used as perches, hatched circles = area usable from a perch in a prey strike (in the majority of prey strikes). Scale is roughly adjusted to proportions in semi-open habitats of the Great Grey Shrike. Slightly modified from Schön 1994.

Fig.3 «Ecological hedgerow management» in landscapes with open natural hedges illustrated by a high grown, tree-like hedge on a mound of stones, in three phases: 1 old tree-like hedge: with a lateral belt of bushes and a central row of trees, stone mound visible at few sites only; 2 immediately after hedge management: trees removed (stubs shown), bushes mostly cut down, few bushes left, stone mound uncovered again; 3 few years after management: most bushes having grown up out of root stocks and forming a hedge, few trees coming up protected by the tallest bushes, stone mound still free of woody plants at numerous points; left section each: narrow side of hedge ("transversal section"), right larger section each: side view of hedge ("longitudinal section"). Symbols: dotted and with dashed line = mound of stones (slightly superelevated), "tussocks" = root stocks of bushes, patches lined unregularly = woody plants (tops of largest trees slightly reduced in height), hatched diagonally = woody plants left after management; section slightly superelevated; scale of axes: in m . Slightly modified from Schön 1994.

Fig.5 «Ecological hedgerow management» of an old-aged hedgerow on a traditional mound of stones: rejuvenescence of tall trees, by cutting the shoots back to the stumps, with few smaller trees and bushes left standing (background-left), stone mound partly uncovered again (light stones: front-center). On traditonal mounds of stones, even tree species of timber woods grow in shoots (light surfaces of cut of the "bunch" of stems of a beech Fagus sylvatica: front). Cut-down branches and stems partly not removed yet (middle-right); situation 4 months after autumnal management. & bsp; Background: additional parallel rows of hedges on stone mounds, still with trees (background-right, view from the narrowside), mostly still untrimmed; border of timber wood (background-left). Great Grey Shrike breeding and winter territory used for >18 years. Plateau of the southwestern Schwäbische Alb, southwestern Germany. Photo 4.4.1995.

Fig.6 «Ecological heath management» in landscapes with bushy heath and heath-wood, illustrated by an open juniper heath (right half each) and a naturally grown wood (left half each), in three phases: 1 situation before management: juniper heath (left) nearly overgrown with scrub complexes and with superannuated tree-like hedge, the latter with a lateral belt of bushes and a central row of trees; naturally grown wood of pines and spruces (right) with multi-crowned older trees in the lower parts and with strongly growing younger trees in the upper parts of the crown stratum, and with young trees and withering thorn and berry bushes in the under storey (long-term shortage of sunlight); surface: woody plants frequently growing at sites with stony ground, often on traditional mounds of stones, now overgrown; small earth mounds (abandoned ant-hills); 2 immediately after management: in the juniper heath (left) most scrubs cut down, young trees removed, few isolated bushes left; in the naturally grown wood (right) strongly growing trees removed from upper crown stratum and under storey, few weakly growing multi-crowned trees (here: pines) and few smaller bushes left; places with stony ground uncovered again, stubs of cut trees (of 0,5 - 1,5 m height) left standing; 3 few years after management: at some places bushes have grown up again out of root stocks, trees that were left poorly enlarged, places with stony ground still largely free of woody plants, crown of isolated tree damaged by wind and ice. Symbols: micro-mound with curly marking = places with stony ground respectively traditional mound of stones, patches lined unregularly = woody plants, pillar-like outline = juniper, hatched diagonally = woody plants left after management; section slightly superelevated; scale of axes: in m .


Fig.9 (top, left) Cleared, deforested ("re-opened") part of a natural pine-spruce wood after «ecological heath management»: most trees are stubbed up (stubs: middle-left, -right), with just a few weakly growing, mostly multi-crowned trees (pines: center, background-right), and a few bushes left standing (front-left, on a stone mound; background-right), and a former mound of stone uncovered again (light stones: front); situation 1,5 years after autumnal mangement. Adjacent: semi-open juniper heath (light brownish colour of grasses: background-left), and closed natural wood (background-right) showing situation similar to condition before management. Great Grey Shrike territory used for >30 years. Plateau of the southwestern Schwäbische Alb, southwestern Germany. Photo 10.4.1997.
Fig.10 (top, right) Re-grazing of a cleared, deforested area in a former natural pine-spruce wood, in the situation 4 years after the last «ecological heath management»: many species of heath plants in the re-grazed soil vegetation (e.g. tussocks of grasses: middle-right), already similar to traditional heaths; bushes left have grown larger (front-left), trees left have gained a rounded shape again (middle-left, -right), stubs still discernible (front-right margin). Background: traditional heath on adjacent rounded hilltop, trees (middle) in line with the border of the former natural wood. Great Grey Shrike territory used for >16 years. Plateau of the southwestern Schwäbische Alb, southwestern Germany. Photo 24.10.1996.
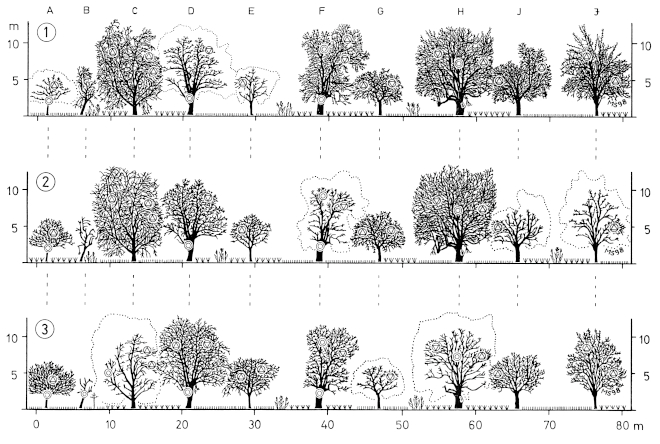
Fig.11 «Ecological management of traditional orchards», in three successive stages with intervals of 5 years: pruning of trees, with preservation of micro-structures (concerning potential nest-sites of open- and hole-nesters, and dead trees), replacement of old trees by planting of young fruit-trees, and multi-strip mowing of the meadows; in each stage with one third of the trees being pruned and two thirds left unpruned (dotted line = outline of initial shape of the tree before pruning). Sections each show the same row of fruit-trees: situation 1 (top): trees A, D, E freshly pruned, the rest of trees left unpruned ("running wild"), tree B withering; situation 2 (middle): trees F, I, J freshly pruned, trees A, D, E with more densely grouped twigs again (new shoots), trees C, G, H still left unpruned and "running wild" even more, tree B left as a standing dead tree ("ruin"); situation 3 (bottom): trees C, G, H freshly pruned, trees F, I, J with more densely grouped twigs again, trees A, D, E with twigs grouped even denser, similar to situation 1, dead tree B decaying with fewer twigs, and left standing, young tree planted nearby gradually replacing dead tree. Symbols in circles = preserved micro-structures in the trees: △ upright triangle = concentrations of twigs (basket-like structures), ▽ inverted triangle = mistletoe Viscum album or outgrow caused by fungus, ◎ circle in circle = larger holes in the trunk or in the branches. Meadows on the area between the trees: used in «multi-strip mowing», with strips of high-grown perennials and herbs as short-term fallow along the margins of plots, and with long- and short-grassed parts mown with different frequency (three little lines = long-grassed, stubbles = short-grassed). Fruit sorts: pear tree: D, F, H, J; apple: A, B, C, E, G, I. Scale in m . Based on photos of fruit-trees in the region of Southwestern Germany.

Fig.12 Conservation of an old fruit-tree (apple) in a landscape with traditional orchards: a clasp (belt) of iron at a crotch of the stem endangered to break asunder, as a traditional method. Preservation of a withering part of the stem, sheltering a breeding hole of the Willow Tit Parus montanus, and at the same time ensuring the yield of fruits in the healthy part of the crown. Northern margin of the southwestern Schwäbische Alb. Photo 1.6.1984.
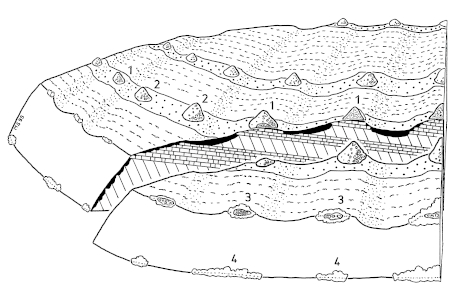

Fig.13 (top, left) Construction of artificial mounds of stones ('cairns', 'Steinriegel') - suitable places for depositing mounds. Top view: 1 on a range of a low rib of land (micro-topographic elevation of little breadth), 2 at the edge of a broader elevation respectively on a micro-plateau, 3 traditional mound of stones ('Steinriegel') at the upper edge of a steep slope, overgrown with scrub, 4 at the lower edge of the slope between scrubs. Section: at micro-topographic ribs: harder rock strata, more resistent to erosion, coming up close to the surface, with stones being turned up by ploughing (resulting in "patches" with stones in the field); in the shallow depressions: less resistent rock strata covered by a thick layer of soil partly alluvial. Artificial stone mounds on strips of land that are uncultivated or cultivated with low intensity. Low hill, slightly arched, with steep marginal parts; direction of ribs of land nearly vertically to contour lines, direction of cultivation nearly parallel to contour lines. Stone mounds strongly enlarged. Symbols: in top view part: marked with irregular little lines = arable land (lines of the plough sods), loosely dotted = strip of land with stone mounds and cultivated with low intensity, heaps with small dots = mounds of stones, patches with irregular outline = bushes; in the section: brickwork pattern = harder, more resistent rock strata (massive rock), hatched diagonally = less resistent geological strata (clay, soft marl), black = soil. Schematic top view combined with section.
Fig.14 (top, right) Construction of artificial mounds of stones ('cairns', 'Steinriegel') - depositing and rearranging of stone mounds in arable fields, in two phases: 1 deposit immediately after dumping of the stones from the tipper vehicle: stone mound rather flattened, stones scattered (rolled from the tipper), stones often in labile positions, stones of larger size located rather at the bottom and farther away, smaller stones rather on top of the mound and closer to the point of deposit (deposit from the right side); adjoining: reaped stubble-field; 2 after rearrangement of the stone mound (by hand, with loading vehicle): more rounded, compact shape and greater height of the mound, protective durable cover ("cap"), larger gaps and hollows near the surface of the mound, as larger stones are put on top of the mound, scattered stones picked up; lining with layer of sand; adjoining: ploughed arable field (right). Symbols: hatched = natural undisturbed soil surface, dots in hatched parts = stones embedded in the soil consisting of the local outcrop strata, patches of irregular outline above soil = deposited stone material with minimum earth content, finely dotted = earth-free sand-dust mixture (here: from a quarry). Scale: in m . Schematic section.


Fig.16 (top, left) Construction of piles of stones, connected by low walls of stones, and lining by a sand layer: final stage of a stepwise construction of artificial stone mounds on strips of land laying fallow, in a landscape with arable fields, and with hedges and juniper heath. Situation after correction: after deposition, arrangement of stones in the mounds altered and stabilized by hand, and layer of sand compressed (layer consisting of a mixture of sand and dust, transforming into a concrete-like solid layer); stone piles up to 2 years old, stone walls and sand layer newly deposited. Background: parallel row of artificial stone mounds. Origin of the material: mostly hewed stones from a roman wall (about 150 A.D., Upper Triassic limestone) from an archaeological excavation, and sand-dust mixture from a quarry (Upper Triassic limestone). Same place as in Fig.17. Great Grey Shrike winter territory used for >6 years. Foreland of the southwestern Schwäbische Alb. Photo 19.9.1997.
Fig.17 (top, right) Landscape with arable fields and with artificial mounds of stones, arranged in two rows of stone piles on strips of fallow land, and adjacent to hedges and juniper heath: constructed with mostly hewed stones from an archaeological excavation, supplemented with stones picked up from the fields (= whitish stones on the pile in front-left, gypsum of Upper Triassic); after deposition, arrangement of the stones on the mounds corrected by hand. Stones coming up through ploughing also discernible in the fields (middle-right, background-left of center). Background: juniper heath (background-right), pine afforestations on former heath (horizon-to the left), in front of it: second row of stone piles. Same place as in Fig.16. Great Grey Shrike winter territory used for > 6 years. Photo 12.3.1997.
Fig.19 Model of the «multi-strip mowing» of a meadow, with an alternation of mown and unmown strips within a single plot of land: changing situations in successive years (vegetation periods), with the rotation of fallow lasting for 1.5 vegetation periods; with different extent of the fallow parts: I entire plot included (fallow part shifting over different parts of the plot), II fallow strip confined to marginal zones of the plot; situations: numbers 1 , 2 , 3 = 1st, 2nd, 3rd year (vegetation period); small letters a , b = summer (a) respectively autumn (b) of the year concerned ( 1a = 1st summer); in each case situation after mowing; categories of fallow: N = newly established, unmown fallow, B = high grown fallow of the year, A = old fallow of the previous year which is newly mown not until late in the year. Schematic section.

Fig.20 «Strip-mowing» of moist, soggy meadows in a valley landscape: unmown strips of 1 - 2 m breadth are left fallow for few years, along the margins of narrow plots (light brownish strips with grasses of the last year; few high-grown perennials: front-right, middle-right of the center). Poorly fertilized meadows, mowed 1-2x annually, between the strips laid fallow (light dots = flowering Cuckoo Flower Cardamine pratensis). Breeding site of the Whinchat Saxicola rubetra, using the perennials as perches; Great Grey Shrike winter territory. Valley of river Ammer, region of the middle course of river Neckar. Photo 20.4.1997.

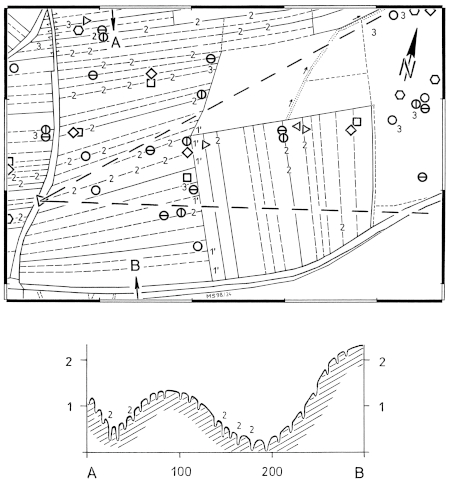
Fig.21 Traditional micro-structures in arable land, and distribution of Skylark Alauda arvensis territories in a (semi-)open landscape with fields: shallow wet micro-depressions at the edges of plots ('ridge and furrow'), and peculiar shape of plots (cluster of plots running crosswise to each other: 'Anwander') in the foreland of the southwestern Schwäbische Alb; at present located in the midst of large and intensively cultivated fields with cereals that extend over several of the former plots; situation directly before consolidation of the farmland. Clumping of breeding sites of the Skylark near these traditional micro-structures.
Top, photo: shallow depression (cf. section, below), joining in the background (NE direction) a larger system of depressions. Situation with ripe cereals (barley: in front, to the left; spring barley: in front, right margin) and root crop (potatoes). 11 July 1997.
Middle, top-view map: modern cultivation units often comprise several traditional plots (narrow strips, so-called "towels"), and thus it is often tilled across the borders of former plots. Thick hatched lines = sector of photo (above), triangle = position of camera; arrows with capitals = position of section A - B (below); thin lines approximately parallel = borders of plots, thin hatched lines = borders of traditional plots crossed by tilling nowadays, drawn-out lines = borders of actual cultivation units; double dotted line with small arrows = drain. Micro-structures: 1 = clumping of abrupt changes in the direction of the borders of traditional plots ( 1 = "place with stunted growth" conspicuous outdoors, 1' = dito deduced from map of plots), 2 = wet, drenched shallow micro-depressions at the borders of traditional plots ('furrows'), 3 = "place with stunted growth" caused by geological conditions, e.g. wet area with weak spring, or depression of a doline ( = dotted oval), 4 = unconsolidated traditional farming lane ('Treppweg', with historical right to crossing out of periods with growing cultures). Breeding sites of Skylark (centers of territories): ▽ triangles with tip pointing downward = broods in 1995 (only in Fig.22), ◇ rhombus = early broods in 1996, □ squares = late broods in 1996, ○ circles = late broods in 1997 (territories after 1 June), ⎔ horizontally orientated hexagon = early broods in 1998, ⬡ vertically orientated hexagon with tip pointing downward = late broods in 1998, ◁ triangles with tip pointing to the left = early broods in 1999, ▷ triangles with tip pointing to the right = late broods in 1999, ⦵ circles with horizontal bar = early broods in 2000, ⦶ circles with vertical bar = late broods in 2000. On basis of censusses of the Skylark population in 1997-2000 (M. Schön) and in 1995-1996 (H. Hermann). Marginal scale: in sections of 100 m .
Bottom: schematic section A - B, 50x superelevated, covering the total of the map (middle): narrow slit-shaped notches = micro-depressions at the borders of traditional plots ('furrows'), caused by traditional use of arable land (throwing together of clods in 'ridge and furrow' fields); depressions with tendency to accumulate moisture and get drenched (due to a layer of loam over formations of gypsum and calcareous carst); rugged structure of soil surface due to modern cultivation practices not shown (i.e. without furrows etc.). Section approximately perpendicular to line of sight in photo (top). Scale: in m , with same longitudinal scale in top-view map (middle) and section (bottom). Top-view map in Fig.21: supplemented with additional data not included in published version in Ecol Birds 22, 2000: 196.

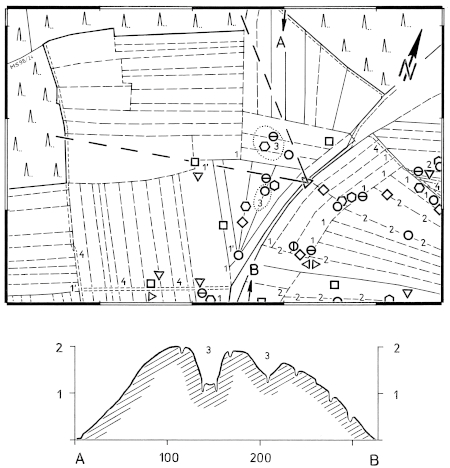
Fig.22 Traditional micro-structures in arable land, and distribution of Skylark Alauda arvensis territories in a (semi-)open landscape with fields: dolines over karst, shallow wet micro-depressions at the borders of plots ('ridge and furrow'), and peculiar shapes of plots (triangle shaped, cluster of plots running crosswise to each other: 'Anwander') in the foreland of the southwestern Schwäbische Alb; at present located in the midst of large, intensively cultivated fields with cereals that extend over several of the former plots; situation directly before consolidation of the farmland. Clumping of breeding sites of the Skylark near these traditional micro-structures. Top, photo: doline (center, background) located on low rounded hilltop, with a broad shallow depression following to the left (direction S) (cf. section, bottom). Situation with ripe cereals (wheat). 11 July 1997. Middle: top-view map. Bottom: section. Further symbols as in Fig.21. Top-view map (middle part) in Fig.22: supplemented with additional data not included in published version in Ecol Birds 22, 2000: 199.
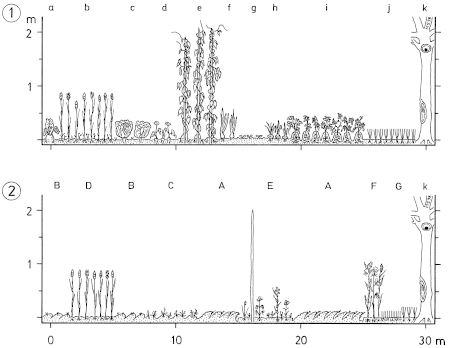
Fig.23 Mimicking of traditional multi-crop cultivation on patches of arable land at the margins of a traditional orchard, by «ecologically orientated ploughing of alternating strips of arable» in short-term intervals. Situation 1 (top): traditional small-scale cultivation of root-crops with alternating crop species: a = fodder beet Beta vulgaris var. rapa, b = cereals (wheat Triticum aestivum, barley Hordeum vulgare), c = cabbage Brassica oleracea var. capitata, d = carrot Daucus carota ssp. sativus, e = runner (string) bean Phaseolus vulgaris var. vulgaris growing attached to poles, f = leek Allium porrum, g = uncultivated strip with bare ground, and with growing lamb´s lettuce Valerianella locusta var. oleracea, , h = onions Allium cepa var. cepa, i = potatoes Solanum tuberosum, j = meadow left tall grassed, k = traditional fruit-tree with high trunk at the margin of a traditional orchard, with holes in the trunk (upper part of trunk: hole in a former base of a branch, lower part: in a sore crack). Situation 2 (bottom): mimicking by small-scale ploughing: A = freshly ploughed strip (clods), B = strip ploughed 1 - 2 weeks ago (seeds of weeds germinating), C = strip ploughed 3 - 5 weeks ago (low natural herbs, partly flourishing), D = strip with cereals (e.g. wheat, barley, spelt Triticum spelta, rye Secale cereale), E = land laying fallow for a short time, partly covered with natural herbs, and with an artificial pole (perch), F = strip of high growing perennials and herbs at the border of the meadow (left standing in the last year), G = meadow near fruit-tree, with alternating short- and long-grassed parts, k = same as above. Section, 4.3 x superelevated (but: plants drawn with natural shape). Scale in m .
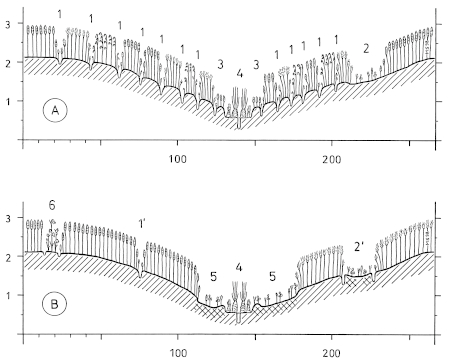
Fig.24 Laying-out of small areas of wet ploughed ground, with gaps in and stunted growth of the herbaceous cover, in soggy, wet parts of open arable land: schematic section of two situations of a landscape with a shallow depression with poorly water-permeable subsoil. A Traditional cultivation practices for arable land: the borders at the longer sides of the plots are situated in shallow micro-depressions ('furrows', 'Grenzsenken'), which are formed by ploughing towards the central parts of the plot ("throwing together" of the clods resulting in vaulted fields, i.e. 'ridge and furrow'), and thus, by the system of these 'furrows', the arable land is protected from becoming drenched or wet on a larger scale; wet parts are only cultivated in dry years. 1 shallow micro-depressions at the borders of vaulted field plots ('furrows' on each side of a 'ridge', longitudinal direction of plots in cross section), 2 partly drenched, wet area, or weak spring, cultivated in dry years only (longitudinal direction of plot in parallel to drawing plane), 3 wet strip of arable land in the lowest parts of the depression, cultivated in dry years only, 4 strip of bog vegetation, with tussocks of sedges Carex, along a small brook (ditch). B Ecolgically orientated cultivation of patches of wet ploughed ground, under modern arable land-use practices: soggy, wet areas, with vegetation with gaps and stunted growth and with uncovered, bare ground, are excluded from intensive cultivation (e.g. by consolidation of farmland plots). 1' shallow micro-depressions at the borders of vaulted field plots ('furrows') that are preserved, 2' drenched patch with weak spring which is preserved (most wet part of 2 ) and cultivated only extensively, at the margins with the soil being compressed artificially ( = cross-hatched), and separated by a deeper furrow from intensively cultivated arable land, 5 drenched, wet area of ploughed ground in the most wet parts of the depression, with the soil being compressed artificially ( = cross-hatched) by a roller, and cultivated only extensively, 6 strip with high-growing vegetation, laying fallow for a short time ('set-aside'), in dry parts of the field (rounded hilltop). Section 25x superelevated, marginal scale in m . Situation during phase with high-grown cereals, rugged micro-structure of soil caused by cultivation (e.g. normal furrows) not shown.
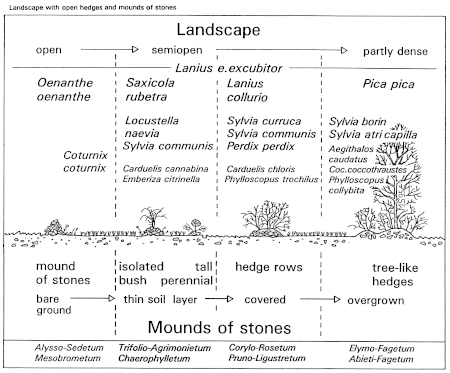
Fig.25 Typical bird species of landscapes with open hedges and with traditional mounds of stones, in relation to stages of different age and size of the hedges, in the succession of vegetation from open land to wood (left margin: pioneer stages, right: climax stage), in the region of the Schwäbische Alb. Top: structure of the landscape ("openness"), and most frequent occurence of the various bird species; lower half: condition and size of the mounds of stones (cairns, 'Steinriegel') respectively of the woody plants growing on them; bottom: plant communities according to phytosociology. Based on long-term studies in the region of the Schwäbische Alb (SW-Germany). Slightly modified from Schön 1994.
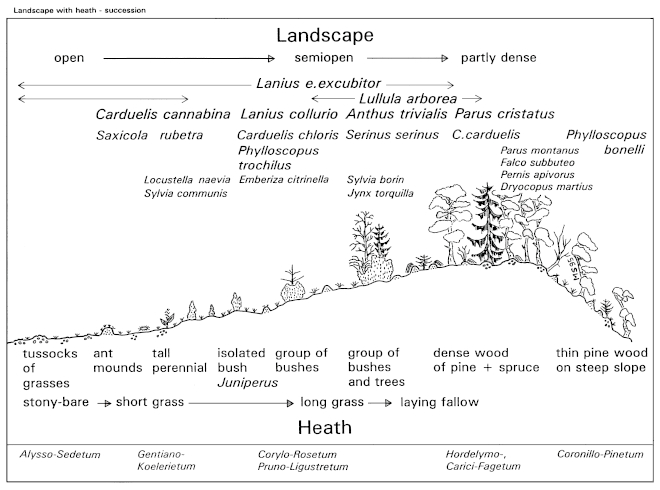
Fig.26 Typical bird species of landscapes with juniper-heath and naturally grown open wood, in relation to stages of different age and size of the woody plants, in the succession of vegetation from open land to wood (left margin: pioneer stages, right: climax stage), in the region of the Schwäbische Alb. Top: structure of the landscape ("openness"), and most frequent occurence of the various bird species; lower half: condition and size of micro-structures respectively of naturally grown woody plants; bottom: plant communities according to phytosociology. Based on long-term studies in the region of the Schwäbische Alb (SW-Germany).
1. The most important causes for the decline of breeding populations of the quail in Central Europe are connected to the intensification of agricultural land-use in cultivated landscapes: with land-use covering the total area exhaustively, shortened rhythms in cultivation, and an increase in the size of the cultivation units (field size), a reduction of the diversity of the cultivated field crops (varieties), and with a massive application of biocides. This results in a reduced food supply for the quail, and in an elimination of within-field micro-structures in arable land and in grassland. Such micro-structures are used preferentially by various species of farmland birds, and have evolved by traditional cultivation practices and / or by micro-topographical geological conditions. These micro-structures form places with gappy and stunted growth of the vegetation (gaps in cultivation). When land-use is intensified, the within-field micro-structures are eliminated (being tilled over, or filled up with ground). Moreover the direct persecution by man (catch, hunting) contributes to the endangering of the species, as well as the alterations caused by climatic changes in the breeding areas (with a climate with stronger atlantic influences) and in the wintering areas (with extended arid periods in the sahel zone).
2. From this, the following guide-lines for the protection of the species may be derived:
2.1 Preservation of still existing traditional micro-structures, by preservation of places with stunted growth of the vegetation: - in arable land: e.g. areas with stony ground where several smaller plots border on each other with their narrow sides, or areas with shallow micro-depressions along the margins of small plots on their longer sides; - in grassland: e.g. temporarily flooded shallow micro-depressions (after melting of the snow, heavy rain, inundation), or more arid places with shallow nutrient-poor soil (with oligotrophic grassland-vegetation). - Preservation of within-field fallow patches, with single isolated bushes, small open hedges, or isolated trees on terraced ground, on temporarily wet or on stony arid places. Attention should be payed to the preservation of the surveyability of the landscape as a whole, with promotion of the pioneer stages of the succession of the vegetation from open to wooded land.
2.2 Preservation and imitation of traditional cultivation practices: - in arable land: e.g. preservation of small-scale alteration of different field crops (i.e. small cultivation units with different crops); - in grassland: e.g. preservation of small-scale alteration of the mowing pattern (i.e. mowing with different frequency and in a staggered time scheme). - Imitation of traditional cultivation practices by: - ecological cultivation of dispersed within-field patches (with small-scaled, non-simultaneous, low-intensity cultivation as far as possible), - ecological mangement of woody plants in fields (with promotion of hedge-like structures, with restraining and rejuvenscence of tree-dominated structures, and with a reduction of the height of woody plants).
2.3 Construction of new micro-structures: - allowing for autonomous development in temporary gaps in cultivation (in areas with still existing traditional micro-structures, in remote areas with few disturbances by leisure activities far-away from roads or country-lanes); - dispersed over large areas (e.g. in distances of 30 - 100 m ). - Reduction of the intensity of land-use in areas with (still) large populations of the quail, e.g. by limitation of application of fertilizers and biocides.
3. Single measures for conservation and management are based primarily on the construction of micro-structures, thus expected to be most effective.
3.1 Construction of soggy patches in arable land: with artificially compressed ground (by rolling after tilling), in already wet places. In this way temporarily inundated patches with stunted growth of the vegetation may develop.
3.2 Construction of artificial mounds of stones, preferably in arable lands: by depositing piles or mounds of stones ( 2 - 4 m in diameter, and 0,5 -1,5 m in height, with 3 - 7 tons of rough, soil-free stone material), at places easy to survey (hill tops, upper edges of slopes), in areas with thin stony soil.
3.3 Multi-strip mowing in grassland: with a small-scale alteration of mown and (temporarily) unmown stripes, caused by a staggered mowing pattern on alternating parts of a larger cultivation unit (with multiple mowing in a year on short-grassed parts, and temporarily fallow at least lasting for 1,5 years on long-grassed parts of a meadow).
3.4 Preservation and construction of within-field patches of fallow land: with temporarily suspended cultivation, and with partial mowing or grazing, between or along the margins of cultivated plots.
3.5 Planting of small groups of low woody plants in fields, with pioneer stages of the succession of woody plants being promoted and preserved as long as possible: by planting dispersed isolated bushes, small open hedges (instead of rows of hedges), and small groups of low trees (instead of high-growing rows of trees).
In four years, habitat preferences of Sky Larks Alauda arvensis during the second and last thirds of the breeding season were studied in two study areas in southwest Germany (1997 - 2000). Sky Larks showed a preference for arable fields with relatively low vegetation, and within the fields, a preference for patches with such low vegetation. Within the fields, places with stunted growth originally caused by traditional cultivation practices, or by geological conditions, were strongly preferred as compared to random distributions (Fig.3, Table 2). About four fifths of all centers of Sky-Lark territories were associated with such places, and about one third of these places were re-used in subsequent years. Such micro-structures with stunted growth of vegetation were often found in areas where several old, smaller cultivated plots border on each other with their narrow sides (ends), or at shallow micro-depressions along the margins of old, much smaller cultivated plots within the larger actual fields, or at depressions of dolines over karst, or at places, that were temporarily wet or stony due to local geology. Conversely, places with stunted growth caused by modern cultivation practices, e.g. edges of actual stands, clay- or grass-covered country-lanes, edges of narrow tarmacked farming roads, and arbitrary places anywhere in the fields were avoided (Fig.3).
For breeding, Skylarks preferred relatively small plots (of less than 3 ha size). Thus, on small-sized plots comprising only 10-20% of the total study area 46-64% of the territories were situated, in densities of up to 13,6 territories per 10 ha (in 1999). Average densities varied approximately parallel in both study areas (middle third of breeding period: 2,7 - 5,5 territories per 10 ha ; last third of breeding period: 2,1 - 4,2 territories per 10 ha ).
Thus, traditional micro-structures in arable land are apparently of great importance for the Sky Lark and other farmland birds. Therefore, such patches with stunted growth should be preserved, or else similar ones should be constructed (in densities of at least 1 - 2 patches per ha ).
The ability to fly is a prominent feature of birds. While the changes during motion concerning morphological structures are well known, the dynamics of optical signals generated by the birds' plumage are hardly perceived. Most studies and illustrations focus on static situations, with birds perching, or flying with wings spread incessantly. But with their capability for active flight, two assumptions seem to be imperative: Birds should show dynamic signal patterns alternating periodically with the wing-strokes. Birds should rely much more on dynamic signalling than on static marking.
When spreading and folding the wing (and tail) during active flight, markings contrasting to the rest of the feather may generate a flashing signal. Contrast may be intensified by "framing". Thus in a wing stripe being periodically "unveiled" in flight, lighter areas may be "framed" by darker parts of the vanes or shafts. Perception of dynamic signals is hampered by their complexity because of changing in size, shape, and orientation during motion. The complete pattern may be visible for few milliseconds only. Dynamic signals may be more conspicuous because of being rapidly switched on and off.
The evolution of contrasting signal patterns may reduce the mechanical stability of feathers. Thus, selection should balance these costs against the benefits of the signal's efficiency. Birds have to be viewed in natural surroundings, on different levels, and in action. A quantitative approach to dynamic optical signals is largely lacking still. Hidden to humans' eyes, dynamic signal patterns extending to the UV may be widespread among birds.
To slow down the decline of Skylark populations, in agri-environment schemes within-field microhabitat structures with stunted growth of the vegetation ("scrapes", "plots") are created artificially for one year each. However, in arable land comparable microhabitat structures may develop spontaneously, and exist over long periods, caused by microgeological features, and traditional cultivation practices. Skylarks, and other species of arable ecosystems, may adhere strongly to such structures. In two study areas in SW-Germany, with fairly high densities of 0.26 - 0.42 Skylark territories / ha, 80.2% of the territory centers were situated near such structures; 32.4% were re-used in different years.
In combination with the observation of further farmland species, e.g. arthropods, at these locations, it is suggested that short-lived structures with stunted vegetation may promote predominantly species with shorter life-cycles, while the longer-lived naturally forming structures may be attractive also for species with higher site-fidelity, or with multi-annual life-cycles.
In many regions, at least traces of these structures are present in fields to date, but rapidly vanishing under use of modern agro-machinery, and thus becoming less effective in causing stunted vegetation. Yet, protection of such quasi self-preserving, sustainable microhabitat structures, adapted to local conditions, could benefit biodiversity. More studies are needed to understand in more detail the ecological role of these undervalued elements of arable ecosystems.
In the Nightjar Caprimulgus europaeus, eyeshine can be observed, with birds showing glowing eyes of a golden-reddish colour when floodlit (flash of camera, torch), and eyeshine being visible from certain directions only (apparent "lighting up" of the eyes when the bird "looks" at the observer) (Fig.1, Fig.2).
Eyeshine is known from several species of nightjars and goatsuckers (Caprimulgi), but apparently from only few other groups of birds (few owls Striges, Ostrich Struthio; Table 1). Eyeshine is caused by a reflection layer, Tapetum lucidum, located behind the retina (Fig.3, Fig.4). Such a layer helps to improve vision in dim light, and was shown to be present in several species of Caprimulgi, and therefore presumably may be present in C. europaeus too.
In addition, eyeshine and a Tapetum lucidum are known from various groups of vertebrates (Fig.5). The reflection layer may consist of different parts of the eyeball tunic (choroidea, pigment epithelium of retina), and may vary in structure (fibrous, or lamella-like type). As an adaptation to vision in dim light, a tapetum lucidum may thus have evolved several times independently. In goatsuckers and nightjars (Caprimulgi), morphological characters (e.g. large eyes, large pupil, reflection layer, large gape, soft feathers, "silent" flight), as well as ethological characters (approaching prey from below against a lighter background, intensifying respectively synchronizing activity and breeding in relation to lunar cycle) may be understood as adaptations to crepuscularity and nocturnality.
Observations are reported on a wild male European Green Woodpecker with missing rectrices, which thus climbed without tail-support (Fig.1 - Fig.6). In this condition, the male took part in the successful excavation of a new nest hole. The "tail-less" woodpecker held its body rather close to the trunk surface (Fig.7). A strong abrasion or shortening respectively defect of rectrices is reported for woodpeckers in literature, and especially for Green and Grey-faced Woodpecker P. viridis, P. canus. Considerable restrictions of locomotion caused by such defects seem to occur only rarely.
A climbing bird is exposed to pulling and pressing forces, and to variable rotational forces (moments caused by lever action), for which it has to compensate. When climbing with the tail used as a support, the feet serve primarily as a hold (counteracting the pulling forces), and the tail serves as a prop and as a spacer to the surface. When climbing without tail-support, the front-toes respectively the upper foot are used mainly as a hold, and the rear-toe(s) respectively the lower foot as a prop (Fig.8). Thus, in a woodpecker climbing without tail-support, the rear-toes also have to take over the part of the tail. It may be possible for woodpeckers to cope with such an additional stress of the feet after loss of the tail because of their relatively long outer toe (IV) which can be orientated to the rear (reversible toe), and because of an on average less intensive use of the tail in woodpeckers frequently foraging on the ground, such as the Green Woodpecker.
1. The facial ruff of owls is only the visible part of a complex of sound receiving structures of the external ear which are hidden in the plumage. In young owls with still growing plumage further details are distinguishable: - the veil of feathers of the facial disk arranged around the eye forming a funnel-shaped hollow (Fig.1); - the feathers of the facial ruff arranged like scales in dense rows, and marking the posterior outward margin of the owl face; on each side of the head, these feathers form an oval trough-shaped conch-like structure (conches of feather), oriented perpendicular to the optical axis (Fig.1, Fig.3); - the facial ruff receding at its posterior lateral margin, and projecting over the tied-up head plumage at its lateral margin (Fig.3); - the orientation of the feathers of the facial disk and ruff towards a center situated slightly below and behind the eye, i.e. the external ear opening (Fig.2, Fig.3), which is visible when the facial disk is moved slightly anteriorly (Fig.4); in the Barn Owl the ear opening is situated on the left side slightly above the level of the right side.
2. The feathers of the facial ruff grow on a postaureal skin fold; they possess a thick closed vane and a shaft (rachis) which is S-shaped at its tip, and rather sound-reflecting properties. In contrast, the feathers of the facial disk grow dispersed over the face, and on a preaural skin fold or flap (operculum); they have a loose bulky and bristly structure without a closed vane, and rather properties of sound-transmission (Fig.6, Fig.7).
3. The conches of feathers of the facial ruff apparently form two paraboloid-shaped reflectors, with the ear opening situated in the focus (Fig. 6, Fig.7), thus greatly improving sound localization. The degree of development of the facial ruff in various species of owl is apparently correlated to habitat and circadian activity: - nocturnal owl species inhabiting denser (wooded) habitats, and/or species feeding on agile prey emmitting high-pitched sounds (e.g. small mammals), have a more prominent facial ruff, and rather make use of their acustic sense when hunting; - crepuscular or diurnal owl species inhabiting more open habitats, and/or species feeding on smaller, less agile and mute prey, have a less developped facial ruff, and rather hunt by sight.
4. In several owl species the external ears of the the left and right side are bilaterally asymmetrical. The asymmetry may be restrained to the membranous fleshy parts, or else may include the ossified parts of the outer ear in the skull. This bilateral asymmetry may improve sound localization in space, especially in vertical direction (elevation); and it may be advantageous for species that locate ground-dwelling prey acustically, and hunt from elevated perches.
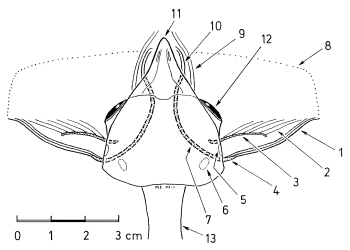
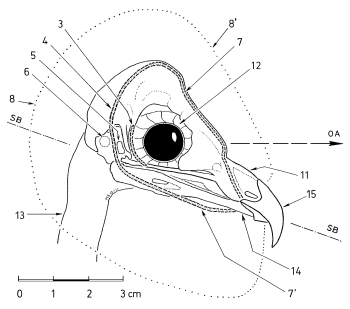
Fig.6 Schematic top-view of the head of a Barn Owl, with the facial ruff and the skull; owl sitting in an up-right stance, with skin folds (flaps) and feathers of the facial ruff drawn in a horizontal plane at the level of the eyes. 1 feathers of the facial ruff (outer part), 2 feathers of the outer part of the facial disk, 3 preaural flap (operculum), 4 postaural fold, 5 external ear opening (external acoustic opening), 6 position of eardrum (tympanic membrane), 7 continuation of the postaural fold on top of the skull (base of fold, dashed line), 8 outline of the facial ruff (tips of the longest feathers) below the bill (dotted line), 9 feathers of the inner part of the facial disk (lore feathers), 10 feathers of the inner part of the facial ruff, 11 upper bill (upper maxilla), 12 eye-ball with ossified sclerotical ring, 13 neck (outline with muscles and skin). Combined after drawings in Dementiew & Iljitschew 1963, D. Meinertzhagen in Pycraft 1898, Nitzsch 1840, Schwartzkopff 1962, and after photos and museum specimen.
Fig.7 Schematic lateral view of the head of a Barn Owl, with the facial ruff and the skull; owl sitting in an up-right stance, head slightly less inclined than in Fig.6; with skin folds (flaps) and facial ruff (outline). OA optical and acoustical axis, SB plane of base of skull and palate; 3 preaural flap: base on the skull, 4 postaural fold: base on the skull, 7' continuation of the postaural fold to the bottom on lower bill (mandible) and throat (dashed line), 8 outline of the facial ruff at the lateral margin, fully spread to the side (dotted line), 8' outline of the facial ruff on the median side between the eyes (dotted line), 14 lower bill (mandible), 15 horny sheath of bill; further notation as in Fig.6. Combined after drawings of D. Meinertzhagen in Pycraft 1898, Norberg 1978, Pycraft 1903, and after photos and museum specimen.
1. Tongue-darting of a wild juvenile Wryneck Jynx torquilla shortly before fledging is documented (Fig.1 - Fig.5). It is known from the Wryneck and various other species of woodpeckers that nearly fledged juveniles may investigate the immediate vicinity with rapid and well-aimed movements of the tongue. In addition, tongue-darting apparently is part of the ordinary foraging behaviour in adults as well. The extraordinary long tongue of the Wryneck has a smooth tip of horn (Fig.10) and can be protruded to about 40 mm (Fig.7). Such an extreme extensibility of the tongue is possible because the rear parts of the hyoid skeleton (i.e. the hyoid horns), and the muscles inserting there (protractor M. geniohyoideus = M. branchiomandibularis) are considerably elongated. In rest position, the tongue extends down the neck forming a loop, and curves up around the skull to the bill (Fig.8, Fig.9).
2. In woodpeckers, morphological characters may be brought in relation to ecological conditions, i.e. life style, and habitat. Species foraging on or near the ground, and mainly feeding on ants ( 'ground woodpeckers', e.g. Jynx torquilla, Picus viridis ), and species foraging on horizontal, decayed-soft wood of branches, show a combination of more or less pronounced characters: - a rather long tongue for catching prey by glueing on, with few bristles at the tip or a smooth tip, and with large salivary glands ('lime-twig', cf. Fig.8 - Fig.11), - a rather slender, narrow bill adapted to probing and picking up, on a rather slender, long skull, - legs adapted to hopping (and grasping), with a rather large spread of the foot, and - a tail with rather high manoeuvrability easy to spread. In contrast to this, species foraging by climbing and pecking on vertical wood of stems ( pecking 'arboreal woodpeckers', e.g. Dendrocopos, Picoides, Dryocopus ) show, more or less pronounced: - a rather short tongue for piercing up prey, with many barbs at the tip ('harpoon'), - a rather short, broad bill adapted to pecking and chiselling, on a rather broad, short, reinforced skull, - legs adapted to climbing, which may be directed sidewards, with feet that may be spread sideward (outer toe may be turned to the side), and with strongly hooked claws, and - a strong tail used as a prop, with rather stiff tail feathers.
3. In evolution, the development of a long tongue with extreme extensibility was linked to an elongation of the protractor muscles (through elongation of the hyoid horns, around the skull, and looping down the side of the neck), and of the retractor muscles (through folding around the trachea). In the evolution of woodpeckers, the basic adaptations may have developped in several crucial steps, such as: - ectropodactyl foot adapted to clinging and climbing (evolving from a zygodactyl foot for grasping), and a tail usable as a prop, - a tongue suitable for catching prey, and - a bill adapted to pecking and chiselling, in connection with an improved ability for climbing with tail support. The Wrynecks Jynginae (tail not used as a prop, bill not adapted to pecking) are most probably derived from a climbing ancestor that used its tail as a prop but did not (yet) have a bill adapted to chiselling. This conclusion is supported by characters of the foot (zygodactyl, suitable for grasping), the tail (broadened "woodpecker-like" pygostyl), and of the tongue (retractor muscle of a simple type).
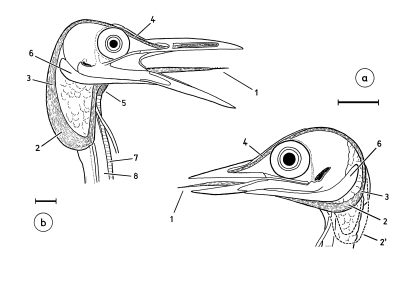
Fig.7 Wryneck Jynx torquilla in the process of tongue-darting: investigating with the extended tongue its nearest surroundings for prey. Tame bird reared by man. Estimation for the length of the tongue nearly maximally extended: about 39 mm, nearly as long as head with bill; from comparison with total body length 16 - 17 cm, length of skull about 43 mm (after Leiber 1907). After a photo in Winkel 1992.
Fig.8 Anatomical basis of the great length and great extensibility of the tongue of 'ground woodpeckers': elongation of the hyoid skeleton and of its muscles, curving down at the side of the neck (forming a 'noose'), and up over the skull, and into the interior of the mandible. a) Wryneck Jynx torquilla, b) Green Woodpecker Picus viridis. 1 horny tip of tongue, 2 curved hyoid horns forming a 'noose' (Cerato- and Epibranchiale; anterior part of the paired hyoid skeleton), 2' approximate position of 'noose' (hatched) of curved hyoid horns in the Wryneck when the tongue is completely retracted, 3 main protractor of the tongue, Musc. geniohyoideus (M. branchiomandibularis), linked to hyoid horns, 4 posterior part of the hyoid skeleton, entering the mandible with the ends of the hyoid horns, 5 main retractor of the tongue, Musc. tracheohyoideus (M. ceratotrachealis) (not visible in a) ), 6 salivary glands (Glandulae sublinguales), secreting sticky slime, extending to rear part of the skull, 7 trachea, 8 gullet (oesophagus). Scale: line = 1 cm. Skin removed from head, mandible drawn opened up to show the end of the hyoid horns. Modified from Leiber 1907a, b.
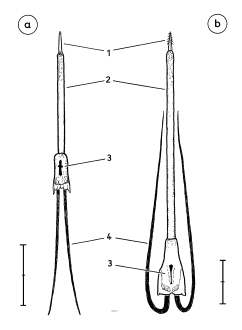
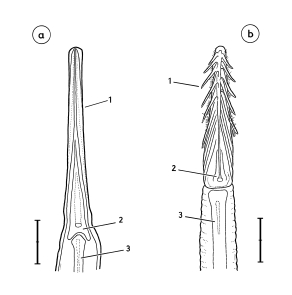
Fig.9 Anatomy of the tongue in 'ground woodpeckers': isolated tongue detached from skull, and put on a plane surface. a) Wryneck Jynx torquilla, b) Green Woodpecker Picus viridis. 1 horny tip, 2 body of tongue ('hose'), turned inside out like a glove finger (unpaired anterior part of tongue), 3 base of tongue with larynx (with laryngeal slit), 4 hyoid horns (paired posterior part of tongue). Scale: line = 2 cm. Modified after Papadopol 1973.
Fig.10 Anatomy of the horny tip of the tongue in 'ground woodpeckers': a) Wryneck Jynx torquilla, with smooth surface; b) Green Woodpecker Picus viridis, with few bristles. 1 tip with horn epithelium, layers parallel to longitudinal axis of tongue ( a ), or orientated tile-like obliquely to axis ( b ), 2 skeletal element of tip of tongue (Entoglossum), 3 bone of body of tongue (skeletal rod). Scale: line = 2 mm. Modified and combined after Leiber 1907, Blume 1981.
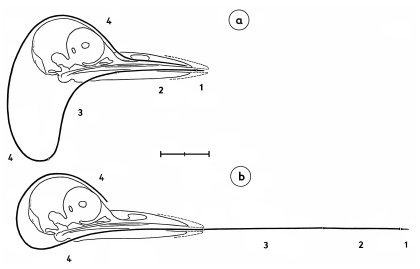
Fig.11 Changes in the position of the hyoid skeleton during the extension of the long tongue of 'ground woodpeckers', illustrated by the Green Woodpecker Picus viridis: lifting and flattening of the 'noose' of the hyoid skeleton, and retraction of the hyoid horns from the interior of the mandible. a) rest position, b) maximum extension. Elements of the hyoid skeleton: 1 Entoglossum, 2 bone rod of body of tongue, 3 anterior part of hyoid horn (Ceratobranchiale), 4 posterior part (Epibranchiale). Dotted = outline of horny sheath of bill; scale: line = 2 cm. Slightly modified after Leiber 1907 (figure slightly modified compared to published version).
1. The Hoopoe (Upupa epops) shows a peculiar behaviour during foraging: the "tossing back of prey". Prey that has been seized with the bill-tip is tossed up and back with a jerk, catched up again nearer to the base of the bill, and then finally swallowed. This long-known behaviour is here documented photographically (Fig.2 - Fig.11), with caterpillars (moth Autographa gamma, Noctuidae) and with larvae of click-beetles (wireworms, Elateridae) as a prey. Preceding swallowing, larger and also soft prey, e.g. caterpillars, may be prepared by being squeezed and moved to and fro (Fig.2, Fig.7a, Fig.11b-11g). Directly before the "tossing back" movement, the bill is mostly lowered (Fig.2, Fig.11i); then the bill is lifted up with a jerk for "tossing back" the prey (Fig.11h-11j). While the freely flying prey approaches the base of the bill, the bill remains in a slightly raised position (Fig.3, Fig.4, Fig.11j), and the neck may be either retracted (Fig.3, Fig.4) or extended (Fig.2, Fig.11j, 11k). While swallowing, the chin and throat feathers respectively ear coverts and genal feathers are mostly slightly raised (Fig.5). During the entire process, the short tongue remains invisible. - By way of contrast, the Spanish Sparrow (Passer hispaniolensis) handles and swallows the same type of prey continuously using the tongue (Fig.14, Fig.15).
2. The behaviour of the Hoopoe when handling prey apparently has never been investigated more in detail, and thus is only known from accidental observations. It seems probable that the most detailed descriptions of the "tossing back" behaviour may be traced back to Bechstein (1795) and Naumann (1826), and apparently therefrom were included even in recent reviews (often without referring to these authors explicitely; cf. Appendix 1). The remarkable rapidity of the "tossing back" movement (often shorter than 1 s; cf. Fig.11h-11k) may be one of the reasons for the finding that this behaviour has been largely neglected. Physically, the tossing back movement of prey may be classified as an 'oblique throw' towards the bird in at least two dimensions, with components of momentum in vertical (upwards) and horizontal direction (towards the bird). The "tossing back" behaviour is usually explained as a consequence of the Hoopoe's extremely short tongue which is unsuitable for helping to move the prey from the tip to the base of the bill. Yet, the Hoopoe's short tongue has a complete hyoid skeleton, and may contribute to the swallowing of prey and to keep free the respiratory duct (cf. Appendix 2). - In contrast to hoopoes, sparrows (Passer) use their tongue to handle animal prey apparently in a similar way as when shelling grain of seed, with culmen and mandible acting like the abutments in a vice, and with the tongue moving the food (Fig.15).
3. The Hoopoe's bill which is solid, massive and laterally compressed is reinforced particularly in its distal parts towards the bill-tip and possesses a broad base on the front part of the skull (cf. Appendix 3). These morphological traits may be interpreted as adaptations to probing and gaping even in harder substrates. As a result of the structure of the bill being mechanically reinforced and resistant to bending, there is no room for a cavity that could hold a long large tongue. - By way of contrast, in wood-hoopoes (Phoeniculidae) that probe in softer substrates the bill-base is less reinforced; and in toucans (Ramphastidae) that pick fruits from trees with their bill-tip, the bill is an extremely light-weight construction and the well-developped tongue is very long. - Furthermore, the Hoopoe's feeding apparatus' structure shows additional traits: the culmen (upper mandible) and the mandible (lower part of the bill) are moveable jointly as well as separately to open and close the bill, and the jaw musculature is reinforced. In this way, a high manoeuvrability of all parts of the bill is generated, and probing and gaping may be facilitated, as well as possibly the "tossing back of prey". - When foraging, the Hoopoe is walking (Fig.9a), or tripping (and not hopping). When probing, mostly with rather short strokes (mean duration of 1,2 s ), the bill may be closed at first, or slightly opened slit-like (Fig.9b, 9c, 9d), and the prey is seized with the bill-tip, after having been localized by optical, tactile, or acustic stimuli. Probing behaviour is apparently innate. Larger prey animals are prepared before being tossed back, e.g. in order to remove projecting or hard parts (such as wings or legs of insects), to kill the prey, or to squeeze out specific contents (cf. Fig.7a, Fig.11a-11g).
4. The "tossing back of food", from the bill-tip into the pharynx, is also known from long-billed relatives of the group of "hoopoe birds" (Upupae), e.g. from hornbills (Bucerotidae) and toucans (Ramphastidae) (cf. Appendix 4). Taking into account the kinship relations of these groups, the evolution of this behaviour may be explained by two alternative hypotheses. Firstly, the "tossing back of food" may have already been present in the common stem-species of the "hoopoe birds" (Upupae, including Upupidae, Phoeniculidae, Bucerotidae), and thus would be a common derivative character (synapomorphy) of the Upupae. Then, "tossing back" would have been lost again in the Phoeniculidae, and evolved convergently in the Ramphastidae (belonging to the group of Pici). Secondly, the "tossing back" behaviour could have been evolved already earlier in the common stem-species of Upupae and Pici, and then having been retained as a primitive character (symplesiomorphy) only in parts of the Upupae group (i.e. in Upupidae and Bucerotidae), and in toucans (of the Pici group). A behaviour comparable to the "tossing back of prey" is not known from Coracii and Alcedini, which are more distant relatives of the Upupae and Pici, not even from long-billed, and short-tongued species. In order to favour one of these two hypotheses for substantial reasons, the occurrence of the "tossing back of food", and the actions performed during swallowing prey in general, should be known in more detail in these groups, and additional morphological and ethological characters of the Upupae, Pici and Coracii would have to be taken into account. - A comparison with the "shaking movements" of foraging long-billed waders (Limicolae) shows that in the "tossing back of prey" of Hoopoes the prey moves detached from the bill in the rather wide-opened bill. Contrastingly, in the "shaking movements" of waders, the prey is more or less pinched in the only slightly opened bill and is shifted towards the base of the bill through repeated detaching and re-grasping of the prey. The "shaking and hurling movements" of curlews (Numenius) when taking up larger animal prey, as well as the tossing actions during swallowing of long-billed storks and ibisses (Ciconiiformes), are most similar to the "tossing back" of Hoopoes.
5. Summing up, it may be concluded that even two centuries after the first more extensive descriptions - originating in the "pre-binocular age" - even basic questions concerning foraging and handling of prey by the Hoopoe need further clarification. A broader knowledge on these topics could be beneficial for effective conservation conceptions for this species too.
Es werden Beobachtungen zur Brutgemeinschaft von Wacholderdrossel (Turdus pilaris) und Raubwürger (Lanius excubitor) mitgeteilt. Eine Wacholderdrossel-Kolonie (wenigstens 27 Adulti, d.h. 13 - 14 Brutpaare) siedelte in unmittelbarer Nachbarschaft zu einem Raubwürger-Nest. Die beiden nächstgelegenen, frisch angefangenen Wacholderdrossel-Nester waren nur ungefähr 10 m vom Würger-Nest entfernt. Nachdem die Raubwürger das fertige Nest in unzerstörtem Zustand aus unbekanntem Grund aufgaben und aus der Nestumgebung verschwanden, waren auch diese beiden Wacholderdrossel-Nester nicht weitergebaut worden und wurden ebenfalls verlassen. Die nächsten Wacholderdrosseln hielten sich danach erst in 50 m Entfernung vom Raubwürger-Nest auf. Es wird vermutet, dass die Wacholderdrosseln die nah beim Raubwürger-Nest gelegenen Nester deshalb aufgaben, weil das nistende Raubwürger-Paar verschwand. Demnach wäre es die Wacholderdrossel, die aktiv die Brutgemeinschaft mit dem Raubwürger sucht (und nicht umgekehrt).
1. Der Raubwürger Lanius excubitor zeigt anderen Vogel- und Säuger-Arten gegenüber verschiedene Abstufungen von Angriffs- und Fluchtverhalten. Das Verhalten ändert sich regelmäßig während des Jahreszyklus' des Raubwürgers (Abb.1 - Abb.12).
2. Der Jahreszyklus des Raubwürgers wird kurz beschrieben.
3. Nach der Größe, Gefährlichkeit und allgemeinen Bedeutung lassen sich die anderen Arten einteilen in sechs Klassen: zwei Klassen von Feinden, solche, die auch für Altvögel, und solche, die nur für Eier und / oder Jungvögel gefährlich sind; in eine dritte Gruppe etwa gleichgroßer Arten, die keine direkte Gefahr mehr darstellen; eine vierte Gruppe der Beutetiere, die Kleinvögel; eine fünfte Gruppe der direkten Nahrungskonkurrenten, die anderen europäischen Würger; und die Gruppe der Säuger.
4. Das interspezifische Verhalten von Lanius excubitor scheint biologisch sinnvoll auf diese Gruppen abgestimmt zu sein (Tab.1). Das Angriffsverhalten ist gegenüber der ersten Feindklasse auf wenige Reaktionen beschränkt, das Fluchtverhalten dagegen fein abgestuft. Die zweite Klasse von Feinden löst umgekehrt ein fein abgestuftes Angriffsverhalten aus, in den meisten Fällen aber bereits ein gröberes Fluchtverhalten. Gegenüber etwa gleichgroßen Arten vereinfachen sich die Reaktionen, Angriffe dienen der Platzbehauptung gegen gleichwertige Partner oder sind Beuteangriffe. Arten, die Lanius excubitor unterlegen sind, rufen ein noch einfacheres Reaktionsschema hervor. - Mit abnehmender Größe und Gefährlichkeit der anderen Arten geht das Feindverhalten von Lanius excubitor über in Revierverhalten bzw. Jagdverhalten. Diese spezifischen Reaktionen und darüber hinaus das unterschiedliche Verhalten gegenüber ähnlichen Arten machen es wahrscheinlich, dass Lanius excubitor zumindest bestimmte Artengruppen, in vielen Fällen aber auch die einzelnen Arten selbst, zu erkennen vermag.
5. Jahreszeitlich betrachtet sind gegenüber allen Arten zwei Höhepunkte im Angriffsverhalten zu beobachten (Abb.1 - Abb.12): zur Brutzeit ungefähr zur Zeit des Flüggewerdens der Jungvögel und im Herbst zur Zeit der Anpaarung. In der übrigen Jahreszeit herrschen Fluchtverhalten und neutrale Reaktion vor. Die einzelnen Arten werden unterschiedlich lange innerhalb des Jahreszyklus' angegriffen, wieder abgestimmt auf ihre Bedeutung für Lanius excubitor.
6. Gegenüber Arten, die für Lanius excubitor noch in anderer Hinsicht von Bedeutung sind als vergleichbar große Arten, ist das Verhalten feiner abgestuft. Elster Pica pica und Eichelhäher Garrulus glandarius stehlen regelmäßig gespeicherte Beute bei Lanius excubitor und wenden dazu wahrscheinlich unterschiedliche Techniken an. Lanius excubitor hat als Gegenanpassung ein Abwehrverhalten entwickelt. Wacholderdrosseln Turdus pilaris bilden Brutgemeinschaften mit Lanius excubitor. Mögliche Ursachen sind Vorteile für beide Seiten, vor allem jedoch für die Wacholderdrossel.
7. Der Anpassungswert der Vogeljagd und das Hassen der Kleinvögel werden besprochen. Die Kleinvogelreaktion kommt auch durch Dressureffekte zustande.
8. Die Jugendentwicklung des interspezifischen Verhaltens wird geschildert.
9. Das Feind- und Revierverhalten einzelner Individuen von Lanius excubitor variiert beträchtlich, bedingt durch verschiedene Faktoren: die Veränderung der Rollenverteilung von Männchen und Weibchen im Laufe des Brutzyklus', die Dominanzverhältnisse innerhalb des Paares, Gewöhnungseffekte, tageszeitliche Abhängigkeit, Abhängigkeit von der Witterung und die Rangordnung verschiedener Verhaltensbereiche.
1. Habitat-Ansprüche: Raubwürger nutzen in Mitteleuropa vier Habitat-Typen: Streuobst-Wiesen-, Steinriegel-Hecken-, Wacholderheide- und Moor-Landschaften. Raubwürger-Habitate zeichnen sich durch eine halboffene Landschaftsstruktur aus, mit Teilbereichen, die mit unterschiedlich großen Holzgewächsen verschieden dicht bewachsen sind. Dabei ist, aufgrund der Größe der Reviere von wenigstens 50 ha, der Aufbau der Gesamtlandschaft wichtig.
2. Veränderungen der Landschaft wurden im Gebiet der Südwestlichen Schwäbischen Alb untersucht, an einer Probefläche (Vorland und Hochfläche, 121 km² groß; Abb.1142-1144), mit zahlreichen langjährig besetzten Brut- und Winterrevieren (Abb.1141). Dabei zeigte sich, dass die von der Art genutzten extensiv bewirtschafteten Flächen stark abnehmen (1978: 53%, 1990: voraussichtlich noch 32% der Fläche von 1960; Tab.257). Noch drastischer ist der Rückgang von größeren zusammenhängenden Extensiv-Flächen (von mehr als 0,5 km²: 1990: nur noch 18% der Flächen von 1960, Tab.258). Ursachen dafür sind u.a. Zerschneidung durch Straßen-, Teerwege-Trassen, Ausweitung der Siedlungsflächen und Nutzungsänderungen, insbesondere Neuaufforstungen mit Fichte.
3. Schutzrelevante Daten: Raubwürger zeigen ganzjährig Kontaktverhalten zwischen den Revieren und brüten oft in lockeren Gruppen. Geeignete Habitate dürfen daher nicht weiter als 2-3 km entfernt voneinander liegen; isolierte Habitate sind nur unregelmäßig besetzt. Raubwürger sind empfindlich gegen Störungen, vor allem zur Brutzeit und gegenüber Hunden. Als Neststandorte werden "verwilderte", dicht bewachsene Stellen in Gehölzen bevorzugt. Bei Nahrungsverknappung ist die Erreichbarkeit von Nahrung entscheidend (z.B. von Kleinvögeln bei Schlechtwetter), wobei "verwilderte" Randbereiche besondere Bedeutung besitzen.
4. Gefährdungsursachen: Vor allem durch die großflächige Intensivierung der Landwirtschaft und den damit verbundenen Rückgang von Insekten und Wildkräutern kommt es zur Nahrungsverknappung. Die Zerstückelung von Habitaten, Zunahme von Störungen durch erleichterte Zugänglichkeit und die Ausräumung der Landschaft durch Beseitigen von Einzelbüschen und -bäumen tragen ebenfalls zur Bestandsgefährdung bei.
5. Als notwendige Schutzmaßnahmen werden vorgeschlagen: - Erhalt von großen zusammenhängenden, extensiv genutzten Landschaften (ortsferne Streuobst-Allmenden; Steinriegel-Hecken-Gebiete und deren Randbereiche; Heiden und Holzwiesen als Hüteschafweiden; Flachmoore und deren Ränder); - Erhalt selbst von kleinflächigen Ödland- und Bracheflächen, Verhinderung der Aufforstung von solchen Flächen an Hängen oder Klingen, Rodung von Aufforstungen (keine "Abrundung"); - Neuschaffung von nicht genutzten oder extensiv bewirtschafteten "Inseln" ('Trittsteine') in intensiv landwirtschaftlich genutzten Flächen (z.B. in den Eckpunkten eines Gitternetzes mit 100 m Linienabstand); - Einschränkung der Erschließung der "freien" Landschaft mit geteerten Feldwegen, durch Rückbau mit geschotterten Zwischenstücken und Unterbindung der Schneeräumung; - ökologische Gesamtplanung für bestehende Brutgebiete, mit einer Einschätzung der Auswirkungen aller Vorhaben (Siedlungs-, Freizeitgebiete, Straßen-, Wege-, Flurbewirtschaftungs-Planungen).
6. Der Raubwürger kann als Charaktervogel der extensiv genutzten, bäuerlichen Kulturlandschaft und als Anzeiger für zahlreiche weitere bestandsbedrohte Arten gelten. Daher besteht Forschungsbedarf bei der Neuschaffung von Teil-Lebensräumen, bei der Lenkung von Störungen und bei den Auswirkungen der Flurbereinigung (-neuordnung).
Sowohl die ungleichmäßige Dichte der Pflanzendecke im Sommer als auch das vorzeitige Ausapern der Schneedecke im Winter sind durch Kleinstrukturen bedingt. Die Bedeutung solcher Strukturen in verschiedenen Habitaten für die Erreichbarkeit der Nahrung und der Zusammenhang mit traditionellen Bewirtschaftungsweisen werden erläutert.
Als Geschlechtsmerkmale des Raubwürgers werden Ausprägung von Arm- und Saumspiegel beschrieben und ebenso wie das allgemeine Zeichnungsmuster unter dem Gesichtspunkt der Signalwirkung näher betrachtet. Anhand dieses Merkmales werden die Geschlechts- und Altersverhältnisse zweier Raubwürgerpopulationen verglichen.
1. Der Schnabel von Würgern Lanius wird seitlich zur Spitze hin schmaler und ist mit Spongiosa erfüllt. Die Hornscheide weist an der Spitze einen Haken und Zahn (im Oberschnabel) und eine Einbuchtung (im Unterschnabel) auf (Abb.1), die sich bei Jungen erst nach dem Ausfliegen entwickeln (Abb.1e). Der Würger-Schnabel funktioniert als Schneide (Abb.2), die Spitze als "Quetsch-Schere".
2. Die Augen von Würgern stehen etwas hervor. Die leichte Einsenkung der Augen-Umgebung (Abb.3) trägt zur Vergrößerung des binokularen Gesichtsfeldes bei.
3. An den Füßen bilden Mittel- und Hinterzehe eine Greifzange, wobei die Sohlenballen der distalen Zehenglieder ein Widerlager für die Krallen bilden (Abb.4).
1. Geschlechtsmerkmale am Flügel beim mitteleuropäischen Raubwürger L.e. excubitor: Das Männchen weist einen großen, bis zu A6 nach innen reichenden Armspiegel auf, eine höchstens schwache Verengung des Flügelstreifs an der Hand/Arm-Grenze, breite Saumspiegel und eine im Flug "aufblitzende" «Verbindung von Arm- und Saumspiegel» und zusätzlich breite helle Schulterflecke. Beim Weibchen ist der Armspiegel kleiner, der Saumspiegel schmäler, die «Verbindung» fehlt und die Schulterflecke sind schmäler (Abb.1-4). Die Zeichnung auf den Innenfahnen der Armschwingen trägt entscheidend zu den Geschlechtsmerkmalen bei, insbesondere die unterschiedliche Breite des hellen Saumes der Innenfahnen bei Männchen und Weibchen (Abb.5). Eine sichere Geschlechtszuordnung ist am ehesten beim fliegenden Vogel anhand von Merkmalskombinationen mit der «Verbindung von Arm- und Saumspiegel» des Männchens möglich (Abb.7, Abb.8). Andere Einzel-Merkmale der Flügel-Zeichnung und Geschlechtsmerkmale auf anderen Körperpartien besitzen eine geringere Trennschärfe (z.B. Kontrast der Unterseiten-Färbung, Schwanz-Zeichnung: Abb.10, Schnabel-Umfärbung: Abb.11). Die Geschlechtsunterschiede werden in zwei 700 km voneinander entfernten Populationen (Südwestliche Schwäbische Alb, Eider-Treene-Gebiet), an Brutpaaren und Überwinterern, gleichermaßen festgestellt (Abb.7) und an Bälgen bestätigt (Abb.8). Ein Vergleich zeigt, dass einzelne dieser Geschlechtskennzeichen auch von anderen Raubwürger-Populationen, Rassen und Würger-Arten bekannt sind. Insbesondere scheinen einspiegelige Rassen von Lanius excubitor sensu lato und der einspiegelige nordamerikanische L. ludovicianus vergleichbare Geschlechtsmerkmale wie die zweispiegelige mitteleuropäische Raubwürger-Rasse L.e. excubitor aufzuweisen («Verbindung vom Saumspiegel her», Beobachtungen im Freiland und an Bälgen, Abb.14). Als nicht geschlechtsgebundenes Zeichnungsmuster kommt ein «innerer Flügelstreif», der der «Verbindung von Arm- und Saumspiegel» entspricht, bei weiteren Lanius-, bei Laniarius-, Nilaus- und Prionops-Arten vor (Abb.16). Die Schwärzung des Schnabels ändert sich jahreszeitlich: zur Brutzeit ist auch die Basis des Schnabels dunkel bzw. schwarz. Die Umfärbung während des Winters ist bei Weibchen sowie Jungvögeln beiderlei Geschlechts verzögert (Abb.11).
2. Altersmerkmale: Eine sichere Altersbestimmung ist am ehesten anhand der hellen Spitzensäume der Großen Oberen Armdecken möglich, die bis ins Frühjahr des zweiten Lebensjahres erhalten bleiben können (Tab.1, Abb.17).
3. Evolution: Ein «innerer Flügelstreif» ist bei den Laniidae wahrscheinlich mehrfach konvergent entstanden. Das Fehlen eines auffälligen Geschlechtsdimorphismus', wie bei Lanius excubitor, kann eine Anpassung an starke saisonale Nahrungsschwankungen sein, die durch winterliche Kälte (boreales bzw. gemäßigtes Klima) oder sommerliche Trockenheit (kontinentales bzw. subtropisches Klima) verursacht sein können.
4. Optische Signale: Zeichnungsmuster scheinen bei Vögeln oft erst mit der Bewegung im Flug zu entstehen. Dabei sind Art und Wirksamkeit eines Signales von mehreren Faktoren beeinflußt: beim Signalsender durch die Deckung der Einzelfedern im Federverbund (vgl. Abb.6 mit Abb.5: nur der sichtbare Teil ist wirksam), die Lage am Körper und die Färbung von angrenzenden Gefiederpartien, wobei eine Kontrastverstärkung am ruhenden (Abb.20: Einrahmung) wie am sich bewegenden Vogel ('Aufblitzen') erzielt werden kann; beim Signalempfänger durch den Kontrast des Hintergrundes, Entfernung des Senders (Nah- und Fernsignale, Abb.18, Abb.19), Dichte des Lebensraumes und Sozialverhalten (Individualabstand). Bei Würgern Lanius finden sich kontrastreiche Zeichnungen eher in offenen Landschaften und bei in Einzelpaaren lebenden Standvögeln; kontrastarme Zeichnungen in dichteren Busch-Wald-Landschaften und bei Gruppenbrütern oder Kurzstreckenziehern.
5. Individuelle Zeichnungsmerkmale: Im Freiland sind Raubwürger L.e. excubitor anhand einer Kombination von Augenbinden und Flügel-Merkmalen individuell erkennbar (Abb.21, Abb.22). An solchen Zeichnungseigenheiten könnten sich auch Individuen einer Art untereinander "persönlich" erkennen.


Abb.1 Geschlechtsmerkmale auf dem entfalteten Flügel beim fliegenden Raubwürger der mitteleuropäischen Rasse L.e.excubitor, halbschematisch (linker Flügel weggelassen).


Abb.2 Geschlechtsmerkmale auf dem entfalteten Flügel beim mitteleuropäischen Raubwürger L.e.excubitor: 2 = «Verbindung Armspiegel - Saumspiegel», 3 = Saumspiegel, 4 = Grenze Hand- / Armspiegel. Armflügel stark gespreizt, um Innenfahnen der Armschwingen zu zeigen.


Abb.3 Geschlechtsmerkmale auf dem gefalteten Flügel beim sitzenden mitteleuropäischen Raubwürger L.e.excubitor, Vogel von der Seite: 1 = Armspiegel, 2 = «Verbindung Armspiegel - Saumspiegel», 3 = Saumspiegel-Fleck, 5 = "Schulterstreif" (aufgehellte Zone). Handflügel leicht geöffnet (äußerste Handschwinge H10 sichtbar).


Abb.4 Geschlechtsmerkmale auf dem gefalteten Flügel beim mitteleuropäischen Raubwürger L.e.excubitor, sitzender Vogel von hinten: 1 = Armspiegel, 2 = «Verbindung Armspiegel - Saumspiegel», 3 = Saumspiegel, 5 = "Schulterstreif" (aufgehellte Zone).


Abb.18 (oben - links) Zeichnungsmuster des fliegenden Raubwürgers Lanius e.excubitor, Männchen: a) Oberseite: weißer Flügelstreif (Hand- + Armspiegel), innerer Flügel-Vorderrand grau-schwärzlich, weißer Flügel-Hinterrand (= Saumspiegel), heller Schulterfleck; zusammengelegter Schwanz fast völlig schwarz (S1 sichtbar); b) Unterseite: durchscheinender weißer Flügelstreif, auf Armschwingen-Innenfahnen zur Federspitze hin auslaufend ("Zacken"), weißer Saumspiegel; übrige Schwingen-Bereiche, einschließlich H10 und Alula am Flügel-Vorderrand: matt schwarz, mit Grauschimmer (hier: voll schwarz); GUHD grau; zusammengelegter Schwanz fast völlig weiß (S6 sichtbar); punktiert: graue Flächen; halbschematisch ( b) leicht verändert gegenüber publizierter Version).
Abb.19 (oben - rechts) Zeichnungsmuster beim 'Bauchzeigen' des Raubwürgers Lanius e.excubitor auf Sichtkontakt-Punkt: weiße Unterseite (Brust, Bauch, Unterschwanzdecken) schwarz "eingerahmt": von leicht abgestellten Flügelbugen (seitlich), von Augenbinde und Schnabel (nach oben), von Füßen und inneren Schwanzfedern (nach unten); verändert nach Foto von V. Olsson.

Abb.20 Kontrastverstärkung von Zeichnungsmustern (Schema): a), b) Einrahmung von schwarzen Flächen durch weiße Begrenzungslinien: a) graue Fläche unmittelbar an schwarzen Streif anstoßend, b) weiße Begrenzungszone (oben schmal, unten breiter); c), e) Einrahmung von weißen Flächen durch schwarze Zonen: c) graue Flächen unmittelbar an weißen Streif anstoßend, d) schwarze Begrenzung oben + unten, e) zusätzlich schwarze Begrenzung seitlich ("Rahmen"); punktiert = graue Flächen. Folgerung: eingerahmte schwarze bzw. weiße Fläche ist als Signal noch auf größere Entfernung wirksam als ohne Rahmen.
1. Der Ablauf der Paarbildung beim Raubwürger L.e. excubitor im Gebiet der Südwestlichen Schwäbischen Alb wird anhand von 5 Verhaltensabläufen beschrieben: Kontakt-Aufnahme, Dominanzverhältnisse und Nahrungsaufteilung zwischen den Paarpartnern, Nestzeige- und Balz-Verhalten. - Sozialverhalten (Abb.1): Paar-Zusammenhalt ist von Anfang Februar bis Mitte Juli (M= 12.5.) und selten im Herbst zu beobachten; Kontakte mit revierfremden Individuen, ebenso wie 'Gruppentreffen' (von im Mittel 4 Ex.), sind in der Zeit davor und danach am häufigsten (Abb.1). Ablauf und Ort der 'Gruppentreffen' und beteiligte Individuen (Entfernung der Herkunftsreviere: x = 1,72 km) machen wahrscheinlich, dass 'Gruppentreffen' meist bei Ansiedlung mehrerer Paare in direkter Nachbarschaft vorkommen. Dies scheint auch bei anderen Vogel-Gruppen mit 'Gruppen-Versammlungen' der Fall zu sein. Der Zeitpunkt der Paarbildung ist in allen mitteleuropäischen Populationen von L.e. excubitor ähnlich. - Dominanzverhältnisse (Abb.2): Mit der Paarbildung ist ein Dominanz-Wechsel vom Weibchen zum Männchen verbunden, was an Sitz-Dominanz (Sitzhöhe von Männchen und Weibchen), In-Deckung-Treiben (Scheinangriffe) und am Deckungssitzen erkennbar ist: bei fest verpaarten Vögeln ist meist das Männchen dominant. Ein Dominanzwechsel von "gleich starken" Individuen zu Männchen-Dominanz in Paaren ist vor allem bei Standvogel-Arten zu erwarten, bei denen Männchen wie Weibchen in Einzelrevieren überwintern, aber beim Brüten das Weibchen vom Männchen versorgt wird. - Nahrungsaufteilung (Abb.3): Die Paarbildung ist mit einem Wechsel von "Selbst-" zu "Fremdversorgung" des Weibchens durch das Männchen verbunden, was erkennbar wird am Selbstjagen des Weibchens (häufig: bis ca. 30 d vor Eiablage), am Wechsel-Speicherfressen (abwechselndes Fressen von Männchen und Weibchen an vom Männchen beigebrachter Beute) und an Balzfütterungen des Weibchens durch das Männchen (Höhepunkt 4 d vor Eiablage). Kopulationen sind am häufigsten in der Phase von 5 d vor und bis 5d nach Eiablage-Beginn. Die Nahrungsaufteilung beginnt erst nach dem Dominanz-Wechsel. Die Synchronisation der Brutpaare scheint relativ hoch zu sein. Während der Paarbildung können Männchen wie Weibchen an auffälligen, ungedeckten Stellen kleine Beute speichern ("Balzspeichern"), die teilweise für Balzfütterungen verwendet wird. Fütterungen mit vertauschten Rollen (Weibchen füttert Männchen) und "Balzspeichern" durch Weibchen sind im Zusammenhang mit dem Dominanz-Wechsel zu sehen. - Nestplatz-Zeigeverhalten (Abb.4-6): Raubwürger, Männchen häufiger als Weibchen, zeigen mögliche Nestplätze durch Schlüpfen in Gehölzen, Hinhüpfen, Anschmiegen und Nestlocken an Ast-Verdichtungen (mit Nestlock-Ruf) an; der Höhepunkt des Zeigeverhaltens liegt ca. 40 d vor Nestbau-Beginn. - Balz-Verhalten (Abb.7): Beim Nahkontakt von Männchen und Weibchen treten Wegsehen, Steilaufrichten und Winkelsitzen auf, meist durch Annähern eines Partners ausgelöst.
Bei der Auflösung der Paarbindung und herbstlichen Anpaarung sind die Verhaltensweisen der Frühjahrs-Anpaarung nochmals zu beobachten (Abb.1). Paar-Zusammenhalt im Winter kommt auch bei anderen Raubwürger-Populationen und -Rassen nur ausnahmsweise vor.
2. Bei "Besuchen" zur Brutzeit können revierfremde Individuen, oft mit Beute, bis zum Nest bzw. Revierzentrum vordringen. Meist sind es Männchen aus den Nachbar-Revieren, oft bereits verpaarte. "Besuche" häufen sich kurz vor und während der Eiablage und beim Ausfliegen der Jungen (Abb.8). "Besuche" können als gegengeschlechtliche Kontakte außerhalb des Paares verstanden werden. Durch Sitzen an exponierten oder gedeckten Punkten können "Besucher" und "Besuchte" beiderlei Geschlechts die Häufigkeit von Außerpaar-Kontakten selbst beeinflussen. Dabei könnte es zu Außerpaar-Kopulationen ("Besuche" von Männchen) bzw. Unterschieben von Eiern ("Besuche" von Weibchen) kommen. "Besucher" bei Bruten mit Jungen können als 'Nesthelfer' geduldet werden.
3. Beim Raubwürger im Gebiet der Südwestlichen Schwäbischen Alb liegen zwischen Nestbau-Beginn und Ausfliegen der Jungen im Mittel 55 d (M= 21.4. - 17.6.). In der Population beträgt die mittlere Dauer der Nestbauphase 7-8 d, der Bebrütungsphase 19 d [17 d] und der Nestlingsphase 24 d [20-21 d beim individuellen Paar]. Demnach sind die Paare hoch synchronisiert (Abb.9). Die Eiablage findet bei L.e. excubitor in Mitteleuropa von Ende März bis Mitte Juni, selten bis Anfang Juli statt; Herbstbruten sind Ausnahmen (Abb.10). Der Brutzeit-Beginn kann sich lokal und großräumig mit Klima und Nahrungsangebot ändern (jahrweise: "frühe"/ "späte Jahre"; mit geographischer Breite: ca. 1 Monat später pro 10° nach N; Abb.11). Südliche Rassen des Raubwürgers (L. [excubitor] meridionalis sensu lato) weisen ausgedehntere Brutzeiten auf, mit regelmäßigen Zweitbruten in manchen Populationen. Im selben Gebiet beginnt die Eiablage beim 'Standvogel' L. excubitor früher als bei Weitstreckenziehern unter den Lanius-Arten. Das Brutzeit-Ende schwankt weniger und liegt bei den meisten Rassen von L. excubitor ähnlich (Abb.11). Es wird dadurch bestimmt, dass Jungvögel noch vor Beginn der nahrungsarmen Jahreszeit selbständig sein und in der Lage sein sollten, effektiv zu jagen. Synchronisation der Paare am Brutzeit-Ende ist daher vorteilhaft. Die Länge der Brutzeit scheint bei nördlichen Populationen an saisonale Temperatur-Schwankungen, bei südlichen Populationen von L.excubitor sensu lato eher an lokale Schwankungen der Feuchtigkeit angepasst zu sein.
4. Im Gebiet der Südwestlichen Schwäbischen Alb läuft die Familien-Auflösung in mehreren Schritten ab: Ausfliegen der Jungen im Alter von 20-21 d; Brut-Aufteilung mit ca. 30 d, vor allem größere und frühe Bruten; letzte Fütterung mit ca. 36 d; Abzug der ersten bzw. letzten Jungvögel und Altvögel des Paares aus dem Brutrevier mit ca. 40 d bzw. 60 d juv.-Alter, M= 7.7. (erster) bzw. M= 24.7. (letzter juv.). Erfolglose Paare verlassen die Brutplätze früher als erfolgreiche ( M= 11.6. bzw. 15.7., Abb.12). Jungvögel ziehen alleine (52% der juv.) oder mit einem (meist dem ersten) Altvogel zusammen ab; die leichtesten Nestlinge oft zuletzt. Erfolgreiche Brutvögel ziehen getrennt nacheinander ab, die Paarbindung wird aufgelöst. Erfolglose Brutvögel wandern früh im Jahr oft gemeinsam, später eher einzeln ab. Der Anteil echter Standvögel ist gering: 1/10 der Überwinterer und 1/3 der an Brutplätzen überwinternden Vögel stammt aus der Brut-Population; nach erfolglosem Brutjahr sind Altvögel häufiger standorttreu.
5. Auch bei anderen Vogel-Gruppen (s. Anhang P21) wird eine Brut-Aufteilung vor allem durch das Nahrungsangebot bestimmt: Aufteilung erfolgt eher bei großen oder späten Bruten, in nahrungsarmen Jahren, in Klimaten mit kurzer Brutzeit. Die Aufteilung erlaubt eine bessere Ausnützung der verfütterten Nahrung und damit des elterlichen Fortpflanzungsaufwandes. Die Familien-Auflösung läuft bei anderen L. excubitor-Populationen und Lanius-Arten ähnlich ab, kann aber in Abhängigkeit von Klima und Nahrungsverhältnissen zu unterschiedlichen Zeitpunkten erfolgen. Im Vergleich zu Greifvögeln und Eulen ist bei Würgern Lanius die Führungszeit flügger Jungvögel im Verhältnis zur Nestlingszeit verlängert. Ausgelöst durch Abwanderung von einheimischen und Zuwanderung von Individuen aus nördlichen Populationen, finden in mitteleuropäischen Raubwürger-Populationen lokale Umsiedlungen in wenigstens 3 Wellen statt. Diese Wanderbewegungen sind durch einen jahreszeitlichen Habitat-Wechsel und möglicherweise durch sommerliche Nahrungsverknappung, sowie innerartliche Konkurrenz bedingt.
6. Paar-Bindung: Die Raubwürger Rassen L.e. excubitor, L.[exc.] m. meridionalis, L.[exc.] m. aucheri (und vielleicht L.[exc.] m. elegans) sind, soweit bekannt, saisonehig. Saisonehigkeit könnte sowohl durch winterliche (aufgrund Kälte) wie sommerliche Nahrungsverknappung (aufgrund Trockenheit) zustande kommen, die ein Verteilen auf Einzelreviere erforderlich machen kann. Dauerehigkeit, die bisher aufgrund der ähnlichen Gefieder-Zeichnung von Männchen und Weibchen vermutet wurde, scheint bei allen Raubwürger-Rassen höchstens ausnahmsweise vorzukommen (bisher in einem Fall nachgewiesen). Die Saisonehigkeit scheint bei den südlichen Rassen von L. excubitor in sommerheißem-wintermildem Klima, aufgrund der geringeren Brutortstreue der Weibchen, sogar ausgeprägter zu sein als bei nördlichen Rassen. "Dauerehiges" Zusammenhalten zeigen am ehesten die ranghöchsten Individuen bei kooperativ brütenden afrikanischen 'Grauwürger'-Arten. Es wird postuliert, dass die Raubwürger-Gruppe von einer solchen tropischen 'Grauwürger'-Form abstammt. Die Aufspaltung in zwei Rassen-Gruppen könnte durch Unterschiede in den Haupt-Beutegruppen, den Jahreszeiten der Nahrungsverknappung und den Habitat-Typen bedingt sein.
7. Fachbegriffe der Verhaltensökologie / Soziobiologie. Für einige englische Fachbegriffe werden neue deutsche Begriffe vorgeschlagen, die den englischen Begriff und den beobachtbaren Sachverhalt möglichst genau wiedergeben (vgl. S.87, S.109-113): cooperative breeding - Gruppenbrüten, courtship storing - Balzspeichern, extra-pair copulation - Außerpaar-Kopulation, extra-pair contact - Außerpaar-Kontakt, mate guarding - Partner-Begleiten.


Abb.1 (oben - links) Soziales Verhalten im Jahreslauf beim Raubwürger L.e. excubitor im Gebiet der Südwestlichen Schwäbischen Alb: Kontakte mit revierfremden Individuen (= 'Kontakte', oben), Gruppentreffen (Mitte) und Paar-Zusammenhalt (= 'Paare', unten); M = Median; Kontakt: zu EV = zu Einzelvogel ("Zweier-Kontakt"), zu BP = zu Brutpaar ("Einzel/Paar-Kontakt"); Paare: Aufl = schwacher Zusammenhalt bei Paar-Auflösung, Bild = dto. während Paar-Bildung, fest = enger Zusammenhalt; Monatssummen (für Paare: 1/2-Monats-Summen); Daten: 1975-1989, an 85 Paaren.
Abb.2 (oben - rechts) Dominanz-Verhältnisse in Brutpaaren bei der Paarbildung des Raubwürgers (L.e.excubitor), in Bezug auf Eiablage (EA); schwarz bzw. dunkel schraffiert: Dominanz des Männchens; Dreiecke = Mediane; Sitz-Dominanz (oben): > dominant über, ≈ ranggleich (ohne bloß kurzfristige Dominanz-Wechsel); In-Deckung-Treiben (Mitte): ♀AW = Ausweichen des Weibchens, BF,K = bei Balzfütterung bzw. bei Kopulation, ♂AW = Ausweichen des Männchens, ♀DR = Drohen des Weibchens, Weibchen weicht nicht aus; ♀-Deckungssitzen (unten): ♀DS,♂SK = Weibchen in Deckung, Männchen auf Sichtkontakt, ♀DS,♂JA = Weibchen in Deckung, Männchen vom Weibchen entfernt jagend. 10 d -Summen, Klasse "EA" = 0-10 d nach 1.Ei; 1975-1989.

Abb.3 Nahrungsaufteilung in Brutpaaren bei der Paarbildung des Raubwürgers L.e. excubitor, in Bezug auf Eiablage (EA); Dreiecke = Mediane; a) ♀-Selbstjagen (SJ) und ♀-Nichtjagen (NJ): ♀LS = kurze Luftstöße des Weibchens in Nestnähe, ♀JA = Weibchen selbständig jagend, außerhalb Nest-Bereich; ♀kJA = Weibchen nur kurz und erfolglos jagend, ♀NJA = Weibchen die ganze Zeit über nicht jagdaktiv; b) Wechsel-Speicherfressen des Paares an vom Männchen beigebrachter Beute; c) Balzfütterung (BF) des Weibchens durch das Männchen: BF-A = außerhalb Nest, BF-N = auf dem Nest, ∑BF = BF-A + BF-N; d) Kopulationen. 10 d -Summen, Klasse "EA" = 0-10 d nach 1.Ei; 1975-1985.


Abb.4 (oben - links) Nestplatz-Zeigeverhalten und Nestbau beim Raubwürger L.e. excubitor im Gebiet der Südwestlichen Schwäbischen Alb: jahreszeitliche Abfolge in Dekaden-Summen (Zählung ab 1.Januar); Dreiecke = Mediane; Nestplatz-Zeigen (NZ): ∑NZ = alle Handlungen, Nl = Nestlocken, As = Anschmiegen, Hh = Hinhüpfen, Sl = Schlüpfen; Nestbau: B = Beginn, E = Ende (fertiges, leeres Nest); Eiablage: Balken = Quartilspanne Q₁ – Q₃, Strich = gesamter Zeitraum; Daten: 1976-1983.
Abb.5 (oben - rechts) Nestplatzzeige-Verhalten beim Raubwürger L.e. excubitor: a) Schlüpfen in ständiger Bewegung, mit Schwanz- und Flügelspreizen; b) Anschmiegen an möglichen Nestplätzen, mit leicht gespreiztem Flügel und Schwanz ( b verändert nach Panov 1983).

Abb.7 Balz-Verhaltensweisen des Raubwürgers L.e. excubitor: a) Wegsehen (oben: Vorderseite, unten: Rücken zugewandt); b) Steilaufrichten; c) Winkelsitzen (oben: Aufsicht, abgewandt, Mitte: Ansicht, unten: Aufsicht, zugewandt; Männchen links, Weibchen rechts, "Profilzeigen" durch jeweils rechten Vogel ( a, b verändert nach Ullrich 1971).

Abb.8 "Besuche" revierfremder Raubwürger L.e. excubitor bei Brutpaaren in der Population der Südwestlichen Schwäbischen Alb in Bezug auf den Brutzyklus: 1.Ei = Beginn der EA, EA = Eiablage, S = Schlüpfen, A = Ausfliegen der Jungen; Gu = Geschlecht unbekannt; 10 d -Summen (außer: Klasse "EA": 4-8 d je nach Gelegestärke; und "Klasse nach EA" = 7d , Schlupf mit 17d ); Daten: 1976-1983, an 16 Paaren.


Abb.9 (oben - links) Jahreszeitliche Lage des Brutzyklus' beim Raubwürger Lanius e.excubitor im Gebiet der Südwestlichen Schwäbischen Alb: NB B = Nestbau-Beginn ("Nest-Anfang" oder Bau des "Außennestes", n=113), NB E = Nestbau-Ende (mit "Innenauskleidung" oder "leeres fertiges Nest", n=102), EA = Ei-Ablage 1.Ei, S = Schlüpfen, A = Ausfliegen der juv.; bei NB: dünne Linie = Gesamt-Zeitraum, Balken = Quartilspanne (Q₁ – Q₃); ⛛ Dreiecke (Datum) = Mediane; Anzahl von Gelegen bzw. Bruten in Dekaden-Summen (Zählung ab 1.Januar); Daten 1977-1984.
Abb.10 (oben - rechts) Jahreszeitliche Verteilung der Eiablage beim Raubwürger Lanius e.excubitor in Mitteleuropa: %-Anteil der Legebeginne (1.Ei); in Dekaden-Summen, ⛛ Dreiecke = Mediane; eB = eigene Beobachtungen Südwestliche Schwäbische Alb, ZF = Zufallsfunde im übrigen Mitteleuropa (nach eigener Zusammenstellung; für Einzelnachweise, s. Abb.11 Nr.14).

Abb.11 Brutzeiten des Raubwürgers Lanius excubitor im gesamten Verbreitungsgebiet von nördlicher und südlicher Arten-Gruppe (L. excubitor s.str. und L. meridionalis s.l.): jahreszeitliche Verteilung der Eiablage (Legebeginne) in Abhängigkeit von der geographischen Breite (°N); ▽ Dreiecke = Mediane, weiße Säulen = Zufallsfunde aus einem größeren Gebiet, schwarze Säulen = Einzelpopulationen, ← → Linien mit Pfeilen = Spanne (ohne genauere Daten); L = Nr. des Literatur-Nachweises (rechter Rand, nur jede 5. Nr. bezeichnet; für Einzelnachweise, s. Ökol. Vögel 16, 1994: 118).

Abb.12 Familien-Auflösung beim Raubwürger Lanius e. excubitor im Gebiet der Südwestlichen Schwäbischen Alb: oben: Abzug der Jungvögel aus dem Geburtsrevier, unten: Abzug der Altvögel von erfolgreichen (⊕) und erfolglosen (⊖) Brutpaaren aus dem Brutrevier; Anzahl der Bruten bzw. Altvögel (ad.): Dekaden-Summen (Zählung ab 1.Januar) und Mediane (Dreiecke ▽ ); Jungvögel: 1.JUV = erster Juv., L.JUV = letzter Juv. der Brut, Altvögel: nach = nacheinander, zus = beide zusammen, unb. = unbekannt ob "nach" oder "zus"; linke Säule pro Dekade = ⊖-Paare, rechte Säule = ⊕-Paare; Daten: juv. 1977-1983, ad. 1975-1984.
1. Beim Raubwürger L.e. excubitor im Gebiet der Südwestlichen Schwäbischen Alb beträgt die mittlere Gelegegröße x = 6,00 Eier und die Größe flügger Bruten x = 4,5 (-5,6) juv. (Abb.1). Das Geschlechtsverhältnis in eben flüggen Bruten ist ausgeglichen (42 Männchen, 42 Weibchen). Gelege- und Brut-Größen sind in anderen mitteleuropäischen Populationen von L.e. excubitor ähnlich (Zufallsfunde: x = 6,10 Eier, Abb.2; x = 4,43 juv., Abb.3). Südliche Rassen von L. excubitor sensu lato haben kleinere Gelege als nördliche (Abb.2). Gelege scheinen in Hecken-Heide- und Moor-Gebieten kleiner und in Streuobst- oder Steppen- und Halbwüsten-Gebieten größer zu sein (Abb.2). In Mitteleuropa hat die 'Standvogel'-Art L.e. excubitor meist größere Gelege als langstreckenziehende Lanius-Arten (Abb.2). Dagegen ist die Jungenzahl (pro erfolgreichem Nest) bei den langstreckenziehenden Lanius-Arten oft gleich groß wie oder sogar größer als bei der 'Standvogel'-Art L.e. excubitor (Abb.3, vgl. Abb.7).
2. Die geographische Variation der Gelegegröße kann verstanden werden: als Anpassung an die Höchstzahl von Jungen, die die Altvögel aufzuziehen vermögen; an Überlebenschancen außerhalb der Brutzeit; oder an den Feinddruck auf Nester. Die stark unterschiedliche Größe von flüggen Bruten (vgl. Abb.3) kann durch Anpassung an rasche Veränderungen der Nahrungsverhältnisse zustande kommen.
3. Im Gebiet der Südwestlichen Schwäbischen Alb sind etwa 2/5 der Paare und Nester und 1/3 der Eier erfolgreich (bis Ausfliegen von juv.; Abb.4). Der Bruterfolg von Paaren ist größer: im Teilgebiet Alb-Hochfläche in allen Jahren, in Streuobst-Revieren in Jahren mit spätem Legebeginn und bei mehrfachen Brutversuchen. Im Teilgebiet Alb-Vorland steigt der Bruterfolg mit der Brutpaar-Dichte (Abb.5). Brutverluste häufen sich direkt nach dem Schlüpfen (Abb.6) und werden zu etwa 1/2 durch feucht-kalte Witterung, zu 1/3 durch Tiere verursacht. Ein Brutpaar beginnt im Mittel 1,4 Nester und 1,2 Gelege pro Jahr (maximale Brutausdauer: 2% der Brutpaare bis zu 3. Eiablage). Ein erneuter Brutversuch ist früh im Jahr und nach Verlust kleiner Nestlinge wahrscheinlicher. Bis zum Ersatzgelege vergehen im Mittel ca. 8 d; der Abstand ist nach Verlust von Eiern geringer.
4. In Mitteleuropa ist bei den Langstreckenziehern L. collurio, L. senator, L. minor der Bruterfolg meist höher und die Gelegegröße sowie Brutausdauer meist geringer als beim 'Standvogel' L.e. excubitor (Abb.7, vgl. Tab.1, Tab.2). Bei L.e. excubitor im Gebiet der Südwestlichen Schwäbischen Alb ist der Ei-Bruterfolg auffallend niedrig. Kleinere Gelege in Hecken-Heide- und Moor-Gebieten (bei teilweise höherem Bruterfolg) können als Anpassung an geringe Nahrungsschwankungen, größere Gelege in Streuobst- und Halbwüsten-Gebieten (Abb.2) als Anpassung an stärkere Schwankungen verstanden werden. Brutverluste sind bei Lanius-Arten in Mitteleuropa vor allem durch feucht-kalte Witterung verursacht und häufen sich während Eiablage und Schlüpfen. In heiß-trockenen Klimaten sind Tiere, in feucht-kühlen Klimaten die Witterung als Verlustursache bedeutsamer, bei unterschiedlicher Empfindlichkeit der Arten. Brutausdauer und -abstände hängen entscheidend von der physiologischen Leistungsfähigkeit des Weibchens ab, wobei die Nachreifung der Ei-Follikel und die Energiereserven des Weibchens bestimmend sind und sich in ihrer Wirkung überlagern. Dies könnte die stark schwankenden Brutabstände nach einem Verlust bedingen.

Abb.1 Gelegegröße und Brutgröße (Zahl flügger Jungvögel) beim Raubwürger Lanius e.excubitor im Gebiet der Südwestlichen Schwäbischen Alb: Gel = Eizahl der Vollgelege, Juv = Mindestzahl flügger Jungvögel pro Brut (N=157 juv.); x = artihmetisches Mittel; n = Anzahl der Gelege bzw. Bruten.


Abb.2 Gelegegröße bei Würgern Lanius in Europa und Nordafrika, in Abhängigkeit von der geographischen Breite (°N): ausgeprägte Abhängigkeit von der geographischen Breite bei L. excubitor, nahezu abwesend bei L. collurio; bei L. excubitor: größere Gelege in Halbwüsten (z.B. Nr.28, 38, 44), kleinere Gelege in Hecken- und Moor-Habitaten (z.B. Nr.10, 11, 13, 19, Nr. 26 HH); arithmetisches Mittel (Symbole) und Spannweite bei Vollgelegen; Symbole: ● ■ ◆ ausgefüllt: n>10, ○ □ ◇ leer: n≤10, ● Kreise = mitteleuropäische Einzel-Populationen, ■ Quadrate = Einzel-Populationen außerhalb Mitteleuropas (bei Arten-Gruppe Lanius excubitor: von Rassen außer mitteleuropäischer L.e. excubitor), ◆ Rauten = Zufallsfunde aus größerem Gebiet mit verschiedenen Populationen, ●- Strich nach rechts = überwiegend Erstgelege; ⎹ senkrechte dünne Striche = Spannweite der Werte, ↕ senkrechte dicke Pfeillinien = Spanne des Mittelwertes (häufigste Werte) mit (n?). Obere Zeile: L = Nr. des Literatur-Nachweises, fortlaufende Zählung für jede Art (nur jede 5.Nummer bezeichnet; für Einzelnachweise, s. Ökol. Vögel 16, 1994: 181-183).


Abb.3 Größe von Bruten bei europäischen Würgern Lanius, in Abhängigkeit von der geographischen Breite (°N): Anzahl flügger Jungvögel pro Brut; arithmetisches Mittel (Symbole) und Spannweite; Symbole: ● ■ ◆ ausgefüllt: n>10, ○ □ ◇ leer: n≤10 (bzw. kleinere Anzahl bei 2 Mittelwerten), ● Kreise = Einzel-Populationen, ■ Quadrate = Einzel-Populationen außerhalb Mitteleuropas (bei L.excubitor: in Rassen außer mitteleuropäischer L.e. excubitor), ◆ Rauten = Zufallsfunde aus größerem Gebiet mit verschiedenen Populationen, -● Strich nach links = teilweise bereits länger flügge Bruten, \ schräg durchgestrichen = teilweise noch nicht flügge Bruten (im Beringungsalter); kleinere Symbole = Einzelfunde, ⎹ senkrechte dünne Linien = Spannweite der Werte, ↕ senkrechte dicke Pfeillinien = Spanne des Mittelwertes (häufigste Werte) mit (n?). Obere Zeile: L = Nr. des Literatur-Nachweis, fortlaufende Zählung für jede Art (nur jede 5.Nummer bezeichnet; für Einzelnachweise, s. Ökol. Vögel 16, 1994: 186-187).


Abb.4 (oben-links) Jahrweise Schwankungen des Bruterfolges (%) beim Raubwürger Lanius e. excubitor im Gebiet der Südwestlichen Schwäbischen Alb 1977-1984. Bruterfolg (BE) bis zum Ausfliegen, mit: Anteil der erfolgreichen Eier = Ei-BE ●, ... Nester = Nest-BE ▼, ...Brutpaare = Paar-BE ■, ... der geschlüpften Eier = Schlupf-BE ○; ◁- horizontale Pfeile = Gesamt-Mittel (BE der Summen, mit: N=530 Eier, 429 geschlüpfte juv., 157-197 flügge juv., 93 Nester, 35 erfolgreiche von 96 Brutpaaren); obere Zeile: n = Anzahl der Brutpaare.
Abb.6 (oben-rechts) Stadium und Ursachen von Brutverlusten beim Raubwürger Lanius e. excubitor im Gebiet der Südwestlichen Schwäbischen Alb; Zeitpunkte (gestrichelte Linien): NBB = Nestbau-Beginn, EA = Eiablage, S = Schlüpfen, AF = Ausfliegen; Brutstadien: NB = Nestbau (erste Hälfte: bis Abschluss des Außennestes, zweite Hälfte: bis leeres fertiges Nest), E = Eier, Bebrüten (erste Hälfte: einschließlich Eiablage), N = Nestlinge (zwei gleichlange Abschnitte), F = flügge Juv. (bis 5 d nach Ausfliegen); unbek. = unbekannte Ursache; nur Verluste von kompletten Nestern, Gelegen oder Bruten; Daten: 1975-1984.

Abb.7 Mittlere Gelegegröße, mittlere Brutgröße und mittlerer Bruterfolg der vier Würger Lanius-Arten in Mitteleuropa: die Langstreckenzieher L. senator, minor und collurio im Mittel mit kleineren Gelegen, aber höherem Bruterfolg, im Vergleich zum 'Standvogel' bzw. Teilzieher L. excubitor; "gewogenes" arithmetisches Mittel der Werte von einzelnen Populationen (nach einem Vorschlag von Schulze-Hagen, Leisler & Winkler): xg = ( ∑ ni xi ) / ( ∑ ni ) , mit: ni = Anzahl der Gelege, Bruten, Nester, xi = arithmetisches Mittel der Population i ; ● Gelege-Größe, △ Brut-Größe (flügge juv. / Nest), schraffierte Säulen = Nest-Bruterfolg (Anteil erfolgreicher Nester), Zahlen = Zahl der gemittelten Populationen bzw. Untersuchungen. Gesamt-Anzahl der gemittelten Gelege na, Bruten nb, Nester nc: L.excubitor (na/nb/nc) = (324/379/156), L.senator (265/237/227), L.minor (252/61/211), L.collurio (2933/2645/2286). Daten für Mitteleuropa (47°-54°N), ohne Untersuchungen für lediglich eine einzige Brutperiode; für Einzelnachweise, s. Ökol. Vögel 16, 1994: 181-183, 186-187, 194-197).
1. Beim Raubwürger L.e. excubitor im Gebiet der Südwestlichen Schwäbischen Alb liegt die Siedlungsdichte zur Brutzeit bei ca. 3 Paare / 100 km² und im Winter bei 7 Individuen / 100 km² (Abb.1, Dichte-Verhältnis: 1 : 2,3 ). Es überwintern fast doppelt soviele Männchen wie Weibchen im Gebiet (Abb.2, Verhältnis Männchen : Weibchen = 1,7 : 1 ) und an Brutplätzen mehr adulte als juvenile Vögel (Abb.3, ad. : juv. = 1,8 : 1 ). 2/5 der Überwinterer, darunter mehr ad. als juv., brüten im folgenden Jahr im Gebiet; 1/10 der Überwinterer und wahrscheinlich nur 1/20 der Brutvögel sind länger als ein Jahr im Gebiet. Das beobachtete Höchstalter liegt bei 4,5 Jahren. Der Brutbestand ist vor allem im Teilgebiet Alb-Vorland rückläufig (Abb.1). In Mitteleuropa liegt die Siedlungsdichte von L.e. excubitor meist bei 5-10 (gewichtetes Mittel: 6,40 ) Paare / 100 km² (Brutzeit) und 5-11 (gewichtetes Mittel: 7,61 ) Ex. / 100 km² (Winter; Abb.5, Dichte-Verhältnis Brut : Winter = 1 : 1,2 ). Da im Winter aber zusätzliche Flächen besiedelt werden, ist der Bestand im Winter oft höher als zur Brutzeit. Die Siedlungsdichte scheint bei nördlichen Rassen nur wenig niedriger als beim mitteleuropäischen L.e. excubitor, bei südlichen Rassen von L. [e.] meridionalis sensu lato dagegen oft deutlich höher zu sein (Abb.5).
2. In Mitteleuropa laufen kurzfristige Bestandsschwankungen in Winter-Populationen meist parallel, in Brut-Populationen eher lokal unterschiedlich ab. Die Brutdichte in einer Population kann auf Teilflächen stark unterschiedlich sein und von Jahr zu Jahr schwanken. Langfristige Dichte-Änderungen werden in Nord-Europa und im östlichen Mittel-Europa (Zunahme 1950-1970/1980), sowie im südlichen Mittel-Europa (Abnahme ab 1950) beobachtet. Ursachen können Schwankungen des Nahrungsangebotes (Kleinsäuger), Landschaftsveränderungen, und zunehmende Störungen durch Menschen sein.
3. Die mitteleuropäische Rasse L.e. excubitor ist Teilzieher, wobei ein Großteil der Weibchen im Winter wegzieht. Die Weibchen von südlichen Rassen (L.[exc.] m. meridionalis, L.[exc.] merid. elegans, L.[exc.] m. aucheri) scheinen noch ausgeprägtere Zugvögel als bei L.e. excubitor zu sein. In Europa ist die Brutortstreue bei Lanius collurio wahrscheinlich ausgeprägter als bei L. senator, L. minor und bei L.e. excubitor im Gebiet der Südwestlichen Schwäbischen Alb; und bei Männchen von L.[exc.] m. meridionalis, L.[exc.] m. aucheri größer als bei L.e. excubitor. Winterortstreue wird bei L. excubitor über maximal 3-4 Jahre beobachtet, was gleichzeitig die mittlere Lebenserwartung eines Individuums sein dürfte.
4. Im Gebiet der Südwestlichen Schwäbischen Alb brüten und überwintern etwa 3/5 der Raubwürger in Gruppen (Brut: max. 5 BP / 2,5 km², Winter: max. 5 Ex. / 5,3 km²), die im Mittel aus 3,22 Brutpaaren bzw. 3,90 Überwinterern bestehen. Der mittlere Abstand der Reviere in einer Gruppe beträgt knapp 2 km (Brut-: 1,63 ±0,31 km, Winter-Reviere: 1,68 ±0,20 km) und der Abstand der Gruppen etwa 4-6 km (Brut: 6,66 ±1,36 km, Winter-Gruppen: 4,14 ±0,38 km; Abb.4). Die Paare im Zentrum von größeren Brut-Gruppen weisen einen höheren Bruterfolg auf. Traditionen bei der Besetzung von Revieren können sich zumindest im Winter ausbilden: Plätze in Nachbarschaft zu länger besetzten Revieren werden bevorzugt (signifikante Korrelation mit der Besetzungsdauer). Gruppen-Bildungen scheinen zum Sozialverhalten des Raubwürgers und weiterer Würger-Arten zu gehören. Dabei scheint bei allen Rassen von L. excubitor der geringste Abstand zwischen Nestern von benachbarten Paaren bei etwa 100 m zu liegen. Vorteile von Brutgruppen könnten ein besserer Feind-Schutz und verringerte innerartliche Störungen des Brutablaufes; Vorteile von Wintergruppen eine "anziehende" Wirkung auf im Frühjahr ankommende 'Zugvögel' und damit verbunden eine frühere Verpaarung sein.

Abb.1 Brut-Bestand (Paare/100 km²) und Winter-Bestand (Individuen/100 km²) beim Raubwürger Lanius e. excubitor im Gebiet der Südwestlichen Schwäbischen Alb: im Gesamtgebiet (links) und im Teilgebiet Alb-Vorland (rechts); signifikanter Rückgang des Brutbestandes im Vorland (lineare Regression); Symbole: ▼ ▽ Dreiecke = Winterbestand, ● ○ Kreise = Brutbestand, + Kreuze = Winterbestand auf Teilfläche A im Vorland, ◁- Pfeil und schraffierter Balken (jeweils rechter Rand) = arithmetisches Mittel ± Standardabweichung; Anzahlen: nW = der überwinternden Einzelvögel, nB = der Brutpaare; bei Gesamtgebiet: ▽ leeres Dreieck, Winter 78/79 = für n=39 Ex. (davon 15 Ex. ohne Alters- und Geschlechtsbestimmung in einem zukünftigen Untersuchungs-Teilgebiet).

Abb.2 Alters- und Geschlechtsverteilung im Winter-Bestand beim Raubwürger Lanius e. excubitor im Gebiet der Südwestlichen Schwäbischen Alb, mit deutlichem Überschuss an Männchen. REV = bezogen auf Reviere ("Überwinterungen"), IND = bezogen auf Individuen (ohne Mehrfach-Zählung von mehrjährig anwesenden Individuen); Alter, Geschlecht: ad = adult ( ≥ vorjährig), juv = juvenil (diesjährig bzw. vorjährig im 1.Winter), Au = Alter unbekannt, Gu = Geschlecht unbekannt; für verwendete Alters- und Geschlechtsmerkmale, s. Schön 1994, Ökol. Vögel 16: 11-80; Daten: Winter 1977/78-1986/87 (ohne Au-Gu-Individuen).

Abb.3 Alters- und Geschlechtsverteilung der Winter-Population des Raubwürgers im SW-Alb-Gebiet, in Abhängigkeit von der Lage der Winter-Reviere in bezug zu Brut-Revieren: Überwinterungen innerhalb und ausserhalb von zuletzt besetzten oder zukünftigen Brut-Revieren. Mehr adulte Vögel überwintern an Brutplätzen. Zuordnung: innerhalb = Überwinterung an Brutplatz, ausserhalb = Überwinterung an nur winters besetztem Platz; Jahr davor = Winter-Revier in bezug auf das Brut-Revier des Vorjahres, Jahr danach = Winter-Revier in bezug auf das Brut-Revier des kommenden Jahres; übrige Abkürzungen wie Abb.2; Daten: Winter 1977/78-1986/87 (ohne Au-Gu-Individuen).

Abb.4 Revier-Abstände (km) in Brut- und Winter-Gruppen des Raubwürgers im Gebiet der Südwestlichen Schwäbischen Alb: arithmetisches Mittel (Dreiecke) ± 99%-Vertrauensbereich (Linien); Brut = in Brut-Gruppen ( ≥2 Paare, 8 Stellen mit Gruppen), Winter = in Winter-Gruppen ( ≥3 Individuen, 9 Stellen); ab = nach außen von der Gruppe zum nächsten besetzten Revier, am = nach außen zum nächsten möglichen freien Revier (im betrachteten Jahr nicht besetzt), ib = nach innen (innerhalb der Gruppe) zum nächsten besetzten Revier, p = zwischen 2 eng benachbarten Überwinterern ("Winter-Paare", z.T. auch außerhalb von Gruppen); n = Anzahl der Einzelwerte (Summe für alle Jahre); für jedes Jahr getrennt: Anzahl der gemessenen Abstände gleich hoch wie Anzahl der besetzten Reviere (für Einzelheiten, s. Methode).

Abb.5 Siedlungsdichte des Raubwürgers L. excubitor im gesamten Verbreitungsgebiet von nördlicher und südlicher Arten-Gruppe (L. excubitor s.str. und L. meridionalis s.l.), in Abhängigkeit von der geographischen Breite (°N): a) zur Brutzeit (Brutpaare/100 km²), b) im Winter (Individuen/100 km²); logarithmische Dichte-Skala; geographische Breite: ungefährer Wert (geordnet nach Reihenfolge, keine lineare Achse), verschiedene Teile eines Gebietes senkrecht untereinander; Symbole: ▲ △ Dreiecke = Maximalwerte, ● ○ Kreise = Durchschnittswerte, ausgefüllte Symbole für größere Anzahlen ( ▲ n≥5 BP bzw. ≥6 Ex., ● n≥11 BP bzw. ≥11 Ex.), nicht ausgefüllte Symbole = Werte für geringe Anzahlen ( △ n≤4 BP bzw. ≤5 Ex., ○ n≤10 BP bzw. ≤10 Ex.), ↕ Symbol mit Pfeilen = arithmetisches Mittel aus 2 Extremwerten (Pfeile = Spannweite), ́ Schrägstrich am Symbol nach rechts oben = ältere Daten vor 1970; gestrichelte Linien = gewichtetes arithmetisches Mittel für Mitteleuropa ( △→ – ←△ obere Linie für Maximalwerte, ◯→ – ←◯ untere Linie für Durchschnittswerte); obere Zeile: L = Nummer des Literatur-Nachweises (nur jede 5. Nummer bezeichnet; für Einzelnachweise, s. Ökol. Vögel 16, 1994: 233-234).
1. Jahreszeitliche Nutzung und Revier-Grössen
1.1 Jahreszeitliche Nutzung: Im Gebiet der Südwestlichen Schwäbischen Alb machen Raubwürger-Habitate ca. 8% der Gesamtfläche des 800 km² großen UG aus. Darin gibt es etwa 2x soviele Winter- wie Brut-Reviere; 9/10 der Brut-Reviere sind ganzjährig besetzt (Tab.1, Abb.6). Ca. 50%-75% des Raubwürger-Lebensraumes bestehen aus nur winters, lediglich 10%-25% aus ganzjährig genutzten Bereichen (Abb.7). Die Reviere liegen in zwei Habitaten: in Streuobst-Gebieten (Abb.2,3) und Hecken-Heide-Gebieten (Abb.4,5). In Hecken-Heide-Gebieten ist der Anteil von Nur-Winter-Revieren größer als in Streuobst-Gebieten. Mindestens 1/4 der Winter-Population besteht nicht aus Altvögeln der Brutpaare. "Freie Plätze" unter Winter-Revieren, die von Jungvögeln oder Einwanderern besetzt werden können, sind in Hecken-Heide-Gebieten häufiger. Jahreszeitliche Änderungen in der Nutzung von Teilflächen lassen sich als räumliche Verschiebungen verstehen, die durch Schwankungen im Nahrungsangebot bedingt sein können.
1.2 Reviergrößen: Winter-Einzelreviere sind ca. 52 ha, Brut-Paar-Reviere 35 ha und Ganzjahres-Reviere des Raubwürgers 68 ha groß (Abb.8); Winter-Reviere in Streuobst- sind größer als in Hecken-Heide-Gebieten (hier: Revier = Aktionsraum der Würger an einem bestimmten Platz). Auch in anderen mitteleuropäischen Populationen von L.e. excubitor sind Brut-Reviere (mit ca. 20-50 ha , gewichtetes Mittel: 43,46 ha ) kleiner als Winter-Reviere (ca. 50-90 ha , gewichtetes Mittel: 56,09 ha ), bei starken Schwankungen. Über große Teile des Verbreitungsgebietes überlappen die Reviergrößen stark, obwohl die größten Reviere bei nördlichen, die kleinsten bei südlichen Rassen (L.[exc.] meridionalis sensu lato) beobachtet werden. In Mitteleuropa waren Brut-Reviere früher kleiner (Abb.9). - Brut/Winter-Schwankungen der Reviergröße sind in Mitteleuropa bei Vogeljägern (Sperber, Habicht) stärker als bei Kleinsäugerjägern (Raubwürger, Mäusebussard). - Bei in Einzelpaaren brütenden Lanius-Arten besteht kein linearer Zusammenhang von Körpergröße und Reviergröße. In bezug auf das Körpergewicht sind Brut-Reviere von L. collurio, L. collaris und L. sphenocercus relativ zu klein; von L. excubitor und nördlichen L. senator-Populationen zu groß (Abb.10). Die Reviergröße hängt stark vom effektiv erreichbaren Nahrungsangebot ab. Unterschiede in der Revier-Größe von nördlichen und südlichen Rassen-Gruppen des Raubwürgers dürften auf Unterschiede im Nahrungsspektrum (endotherme Beutetiere bei L. excubitor sensu stricto bzw. exotherme Beutetiere bei L. [exc.] meridionalis sensu lato) zurückzuführen sein, in Verbindung mit einem abrupten Wechsel zwischen den Beute-Gruppen und einem sprunghaften Anstieg der Nahrungsdichte beim Übergang von kühlen zu heißen Klimaten. Dies würde auch die kleineren Reviere der Wüsten-Rassen L.[exc.] merid. elegans und L.[exc.] m. pallidirostris aus der südlichen Rassen-Gruppe erklären.
2. Struktur-Merkmale
2.1 Gehölz-Abstände: Brut/Winter-Unterschiede: Gehölz-Abstände in nur bzw. auch winters genutzten Bereichen sind größer als in nur zur Brutzeit genutzten (Abb.13, Abb.14). Auch die relative Spannweite der Abstände (Spannweite zwischen erstem und drittem Quartil) ist in Winter-Revieren größer als in Brut-Revieren (Abb.16). Winter-Reviere an ganzjährig besetzten Plätzen und an nur winters genutzten Plätzen weisen ähnliche Abstandsverteilungen auf; nur winters besetzte Reviere sind lediglich in Teilbereichen noch offener. Für den Raubwürger-Lebensraum ist zu allen Jahreszeiten ein kleinräumiger Wechsel von dichter und locker bestandenen Bereichen charakteristisch (Abb.15; "Abstandsvielfalt"). Gehölz-Abstände sind in länger besetzten Brut-Revieren kleiner (Abb.16). Nur einmal besetzte Brut-Reviere sind in ihren Abständen länger besetzten Winterrevieren ähnlich. Mittelwerte: Der mittlere Gehölz-Abstand im Raubwürger-Lebensraum der Südwestlichen Schwäbischen Alb liegt bei M= 35,88 m (Abb.12); 3/4 aller Abstände sind < 100 m . Die Obergrenze der mittleren Wartenabstände in Bereichen, die vom Raubwürger "gerade noch" genutzt werden (können), liegt bei ca. 50-60 m. Das Abstandsmittel beträgt in Brut-Revieren etwa M= 30 m , in Winter-Revieren etwa M= 45 m (Abb.13). In der Reihenfolge von nur zur Brutzeit - ganzjährig - nur winters genutzter Rasterflächen nimmt entsprechend der Anteil von großen Abständen ( > 100 m ) zu, der Anteil kleiner Abstände ( < 20 m ) ab (Abb.14).
2.2 Wartendichte: Brut/Winter-Unterschiede: Die Wartendichte ist auf zur Brutzeit genutzten Flächen höher als auf winters genutzten (Abb.19, Abb.20). Im Winter-Revier sind ca. 55% der Fläche sehr offene (0-4 Warten/ha) und 20% sehr dichte (10-500 Warten/ha) Bereiche; im Brut-Revier 40% sehr offene und 35% sehr dichte Bereiche. Bereiche mittlerer Dichte (5-10 Warten/ha) machen, unabhängig von der Jahreszeit, ca. 25% der Fläche aus (Abb.21). Größenordnungen: Im Raubwürger-Lebensraum der Südwestlichen Schwäbischen Alb liegt die mittlere Wartendichte bei etwa 5 Warten/ha (mit wartenfreien Rastern; Abb.22; Median aus den für jedes 1 ha-Raster getrennt ermittelten Wartendichten). Offene und dichte Bereiche wechseln kleinräumig ab (Abb.18, Abb.21). Im Vergleich zu Wäldern sind Raubwürger-Habitate halboffene Lebensräume. Wald-Bereiche sind in jedem 30. 1ha-Raster, künstliche Warten in jedem 100. 1ha-Raster die einzigen Warten.
2.3 Grund-Flächen: In der Flächengröße von Gehölzen bestehen keine ausgeprägten jahreszeitlichen Unterschiede: Holzgewächse sind in Brut und Winter-Revieren gleich groß. Lediglich für Teile der Reviere lassen sich Größen-Verschiebungen nachweisen: Gehölze sind in nur zur Brutzeit genutzten Bereichen kleiner als in ganzjährig oder nur winters besetzten. Auch bei Wald-Bereichen sind keine jahreszeitlichen Größen-Verschiebungen nachweisbar. Die Schwankungsbreite der Gehölzflächen in einem Revier ist größer als die Variation zwischen Teilbereichen, die während eines Jahres genutzt werden. Nach Freiland-Messungen sind frei stehende Holzgewächse im Raubwürger-Lebensraum (mit im Mittel ca. 6 m ) etwa so "breit" wie hoch. Mittelwerte: Im Raubwürger-Lebensraum der Südwestlichen Schwäbischen Alb liegt die mittlere Grundfläche von Gehölzen bei M= 31,07 m². 4/5 der Gehölze sind < 100 m² ; 1/4 < 6,3 m² (Abb.23). Eine Obergrenze für die Flächengröße in vom Raubwürger regelmäßig genutzten Gebieten liegt bei ca. 40 m² . Wald-Teilflächen, die sich in 1/4 der Raster finden, sind im Mittel ca. 1800 m² groß. Das Flächen-Mittel beträgt in nur zur Brutzeit ca. 22 m² , in ganzjährig und nur winters genutzten Bereichen ca. 33 m². Der geschätzte Deckungsgrad der Holzgewächse (mit Wald) liegt bei maximal 17%-21% und für verstreut stehende Gehölze (ohne Wald) bei maximal 11%-14% .
2.4 Holzgewächs-Typen: Jahreszeitliche Unterschiede: In Raubwürger-Winterrevieren ist die Anzahl von Hecken-Strukturen, Einzelbüschen und Hecken i.e.S. größer als in Brut-Revieren am selben Platz (Abb.24). Im Brut-Revier ist die Dichte von Baum-Strukturen und Holzgewächsen insgesamt höher (Abb.25). Länger besetzte Brut-Reviere weisen höhere Dichten von Holzgewächsen auf (signifikante Korrelation). Größenordnungen: Im Raubwürger-Lebensraum der Südwestlichen Schwäbischen Alb stehen mehr Hecken-Strukturen (6 HS/ha) als Baum-Strukturen (4 BS/ha) und in 1/4 der 1ha-Raster gibt es Wald-Bereiche. Die Mehrzahl der Baum-Strukturen sind Einzelbäume (92,0%), die meisten Hecken-Strukturen sind Einzelbüsche (85,8%). In einem Brut-Revier (bzw. Winter )Revier stehen 200 (180) Baum- und 110 (170) Hecken-Strukturen; in einem Ganzjahres-Revier je 300 Baum- und Hecken-Strukturen (Abb.24, vgl. Abb.25).
2.5 Verteilung der prägenden Holzgewächs-Typen: Jahreszeitliche Änderungen: In zur Brutzeit genutzten Bereichen ist der Flächen-Anteil höher, der von habitateigenen Holzgewächs-Typen geprägt ist (Streuobst- bzw. Wacholder-Raster). In winters genutzten Bereichen ist der Anteil der Hecken-Raster, die beiden Habitaten gemeinsam sind, größer (Abb.27). Habitat-Eigenheiten im Bereich der Südwestlichen Schwäbischen Alb: In Streuobst-Habitaten sind 40% der Fläche von Hecken und 60% von Streuobst-Bäumen geprägt; in Hecken-Heide-Habitaten 80% von Hecken und 12% von Wacholder-Büschen (Abb.26). Nadelholz-Aufforstungen gibt es vor allem in Streuobst- bzw. Vorland-Gebieten (in 15-20% ) und häufiger in Winter-Revieren; in Hecken-Heide- bzw. Hochfläche-Gebieten eher Hochwald (in 20%) bzw. Kiefern-Fichten-Aufwuchswald (Hochfläche: in 10% der Raster). Feuchtstellen sind wichtiger Bestandteil der Raubwürger-Habitate (Bachhecken im Alb-Vorland: in 20%); künstliche Warten (Straßenrand-Bäume, elektrische Überlandleitungen, Feldgärten, Bahndämme mit Telefonleitungen) sind von untergeordneter Bedeutung (in 1 - 3% der Raster).
2.6 Haupt-, Schlaf- und Mauserplätze: In Raubwürger Revieren gibt es 4 - 5 'Hauptplätze' von ca. 300 m² Grundfläche, die als hauptsächlich genutzte Fress-, Ruhe- und Übersichtsplatz dienen; sowie 2 Schlafplätze; und 1 Mauserplatz, der als Hauptaufenthaltsgehölz in der Mauserzeit dient. Im Sommer genutzte Hauptplätze sind kleiner als winters genutzte. Meist werden Hecken-Strukturen (Abb.28a) mit Dornbüschen, am Rand zu wartenfreien Bereichen, gewählt. Schlafstellen in Schlafplätzen befinden sich meist in der Mitte; Ruhestellen in Mauserplätzen eher am Rand der Gehölze (Abb.28b). Ausschlaggebend für die Wahl als Haupt- und Schlafplatz scheint vor allem der Schutz vor Feinden (durch Deckung und Dornen) und vor Auskühlung zu sein; beim Mauserplatz daneben die Möglichkeit zum Sonnenbaden.
2.7 Vergleich der Struktur-Merkmale: Im Raubwürger Lebensraum der Südwestlichen Schwäbischen Alb stehen etwa 10 [5] Holzgewächse / ha (ohne [mit] Berücksichtigung der Verteilung; Abb.25 [Abb.18]), bei einem mittleren Abstand von etwa 35 m (Abb.12); die mittlere Größe der Gehölze (Grund-Fläche) liegt bei 30 m² (Abb.23). Obergrenzen für Gehölz-Abstände liegen beim 1,7fachen des Mittels (entsprechend einem mittleren Abstand von 50 - 60 m ) und für Gehölz-Flächen beim 1,2fachen des Mittels (entsprechend einem mittleren Gehölz-Durchmesser bzw. -Höhe von 7 m ). Der halboffene Raubwürger-Lebensraum ist durch einen Wechsel von dichteren und offeneren Bereichen mit größeren und kleineren Gehölzen gekennzeichnet ("Größenvielfalt" der Abstände, Wartendichte, Flächen). Die Schwankungsbreite von Gehölz-Abständen bzw. -Größen lassen sich, ebenso wie die Anzahl der Haupt-Speicherplätze in einem Revier, als Habitat-Ansprüche der Art Raubwürger verstehen. Habitat-Unterschiede zwischen Streuobst- (SO) und Hecken-Heide-Gebieten (HH) bestehen im Anteil von jeweils habitateigenen Strukturen (Abb.26) und bei Grund-Flächen der Holzgewächse (SO 40 m², HH 25 m², Abb.29; spezielle Struktur-Merkmale). Durch den höheren Anteil von Hochwald in Hecken-Heide-Gebieten und von Jung-Aufforstungen in Streuobst-Gebieten verringern sich die Habitat-Unterschiede (vgl. Abb.31). Im Ganzjahres-Revier stehen in Streuobst-Gebieten 450 Baum- und 150 Hecken-Strukturen; in Hecken-Heide-Gebieten 450 Hecken- und 150 Baum-Strukturen (Abb.32). Jahreszeitliche Unterschiede ergeben sich für Zahl und räumliche Verteilung der Holzgewächse insgesamt (allgemeine Struktur-Merkmale). Zur Brutzeit genutzte Bereiche sind dichter und mehr durch Baum-, im Winter genutzte offener und mehr durch Hecken-Strukturen geprägt. Zur Brutzeit sind jeweils habitateigene, im Winter eher beiden Habitaten gemeinsame Strukturen kennzeichnend.
3. Veränderungen von Landschaftsaufbau und Zugänglichkeit: Die Holzgewächse in Raubwürger-Habitaten waren "1956" viel kleiner als "1979": die mittlere Grundfläche stieg von M= 12,85 m² auf M= 34,03 m²; der Anteil kleinflächiger Holzgewächse ( < 25,0 m² ) ging von ca. 75% auf 45% zurück (Abb.33). Auch die Größe der Wald-Teilflächen in den 1 ha-Rastern stieg von M= 775,0 m² auf M= 2050,0 m² deutlich an. Die Abstände der Holzgewächse erhöhten sich von M= 24,38 m auf M= 30,88 m (Abb.34). Die Zugänglichkeit der Raubwürger-Reviere ist erleichtert worden. "1988" liegen nur noch 23,1% der Reviere in "Gebieten" ohne Teerwege ("1956": 100,0% ). Trotzdem führen durch 58,7% der Reviere auch heute noch nur Erd-Gras-Wege. Ganzjährig besetzte Reviere (GJ) liegen häufiger in Gebieten ohne Teerwege als nur winters besetzte Reviere (GJ: 41,5%, NurW: 19,0% ), was mit verringerter Zugänglichkeit der Gebiete im Winter zusammenzuhängen scheint. 91,3% der Reviere liegen in ortsfernen Teilen der Gemarkung: an der Gemarkungsgrenze oder in den ortsfernsten Teilen der offenen Feldflur (Abb.35). Die Lage der Reviere kann durch das Meiden von Störungen bedingt sein. Die Vergrößerung der Abstände und Grundflächen von Holzgewächsen in den Raubwürger-Revieren spiegelt Veränderungen des Landschaftsaufbaues im Mitteleuropa des 20. Jahrhunderts wider: das Verschwinden verstreuter Einzelbüsche und -bäume aus intensiv genutzten Bereichen und das Zuwachsen von nicht mehr bewirtschafteten Bereichen mit Gebüschen und Wald (Abb.36-38).
4. Räumlicher Aufbau des Lebensraumes und Sichtkontakt-Verhalten
4.1 Raubwürger-Reviere im Gebiet der Südwestlichen Schwäbischen Alb liegen meist an Höhenrücken oder auf Kuppen (Abb.39,40); enge, am Rand bewaldete Täler werden gemieden. Benachbarte Reviere stehen in Sichtverbindung (Abb.41,42). Haupt-, Schlaf-, Mauser- und Nestplätze in den Revieren befinden sich ebenfalls in exponierter Lage (Abb.43) und weisen gute Sichtverhältnisse auf. Die Übersichtlichkeit der Reviere ist beim Wartenjäger Raubwürger für Erreichbarkeit von Nahrung wie Schutz vor Feinden entscheidend. Unterschiede im Landschaftsaufbau bedingen unterschiedliche Sichtverhältnisse.
4.2 Raubwürger treten durch Sitzen auf erhöhten Punkten und Hochflüge in Sichtkontakt. Dabei werden meist Stellen mit Gelände-Übersicht (wie Kuppen, obere Hangkanten) aufgesucht (Abb.44). Für Sichtkontakt-Sitzen genutzte Punkte können am Rand wie im Zentrum der Reviere liegen; zur Brutzeit häufiger im Zentrum. Bei gleichzeitigem Sichtkontakt-Sitzen beträgt der mittlere Abstand zweier Raubwürger etwa 400 m . Bei Sichtkontakt-Hochflügen, die im Mittel etwa 400 m weit und 50 m hoch reichen, entfernt sich der Revierbesitzer höchstens bis zur Reviergrenze, und Revierfremde nähern sich von außen höchstens bis in die Grenzzone (Abb.45). Sichtkontakt-Verhalten ist vor allem während der Paarbildung, Familien-Auflösung und Winterrevier-Besetzung häufig (Abb.46). Beim Sichtkontakt-Sitzen sind meist 2 Individuen gleichzeitig und häufiger Männchen beteiligt; bei Sichtkontakt-Hochflügen meist nur 1 Individuum und Männchen wie Weibchen gleich häufig beteiligt. Sichtkontakt-Sitzen ist oft mit Bauch-Zuwenden (Hindrehen der Unterseite) verbunden, zumindest von einem der beiden Raubwürger, und erfolgt im Mittel bereits in einem Abstand von ca. 400 m . Sichtkontakt-Verhalten dient beim Raubwürger vor allem dem Revier-Anzeigen (vgl. Abb.45) und tritt während Umsiedlungen in der Population gehäuft auf. Brut-Reviere werden vor allem von Männchen angezeigt. Die Abstände zweier Individuen beim Sichtkontakt-Sitzen ebenso wie die Extrem-Abstände zum/vom Revierzentrum bei Sichtkontakt-Hochflügen liegen in der Dimension der Reviergröße und spiegeln auch Unterschiede von Brut- und Winter-Reviergröße wider. Ein Individualabstand von etwa 150 m (beim Sitzen) und 65 m (bei Hochflügen) wird kaum unterschritten. Raubwürger besitzen ein ausgezeichnetes Sehvermögen, wie aus Abständen beim Bauch-Zuwenden (max. 1600 m ) und beim Sichtkontakt-Sitzen (max. 2100 m ) oder bei der Reaktion auf Beutetiere (max. 1000 m auf fliegenden Sperlingsvogel) zu schließen ist (s. Anhang H20 ). Eine Bevorzugung exponierter Stellen in der Landschaft, ebenso wie Wartensitzen auf erhöhten Punkten, ist auch von Greifvögeln, Rabenvögeln und Schmetterlingen bekannt. Durch Thermiksegeln können Greifvögel ein räumliches Revier und dies auch über unübersichtlichem Gelände beanspruchen. Im Gegensatz dazu können Würger mit Sichtkontakt-Sitzen nur ein zweidimensionales Revier in halboffenen Landschaften anzeigen.
5. Aufbau des Raubwürger-Lebensraumes in Kultur- und Natur-Landschaften
5.1 Raubwürger-Habitate im gesamten Verbreitungsgebiet der Art stimmen in allgemeinen Struktur-Merkmalen weitgehend überein: es handelt sich um halboffene Landschaften mit verstreuten Gehölzen. In Natur- und Kultur-Landschaften werden die Habitate von wenigen Gehölz-Arten aus wenigen Gattungen geprägt (Nadelholz-, Wildobst- und Dornbusch-Arten). In der Sukzession zum Wald können offenere Bereiche einer halboffenen Landschaft zunächst als Winter-Reviere und bereits dichtere Teile als Brut-Reviere genutzt werden. In Natur-Landschaften finden sich Raubwürger-Habitate an Waldgrenzen in bewaldeten Großräumen oder an gehölzbestandenen Sonderstandorten in ansonsten gehölzfreien Großräumen; so bei nördlichen Rassen an offenen Stellen im Taigawald oder am Taiga-Tundra-Übergang (L. exc. melanopterus, L. exc. sibiricus, L. exc. funereus, L. exc. mollis); bei südlichen Rassen an Feuchtigkeit ansammelnden Stellen mit Gehölzen in Steppen und Wüsten (L. [excubitor] meridionalis elegans, L. [exc.] m. aucheri, L.[exc.] m. pallidirostris).
5.2 In Kultur-Landschaften liegen bei der Rasse L.e. excubitor 1/2 der Brut-Habitate in von Bäumen geprägten Bereichen (Streuobst-, Einzelbaum-, offene Wald-Landschaften); umgekehrt 4/5 der Winter-Habitate in Busch-Hecken-Landschaften (Abb.47). Eine jahreszeitliche Habitat-Verschiebung, von Baum- (Brut-) zu Hecken-Landschaften (Winter-Reviere), ist für die meisten Rassen von L. excubitor sensu lato und für andere Lanius-Arten erkennbar. Historisch neubesiedelte Habitate (Nadelholz-Aufforstungen, Talsperren-Gelände, Ton-, Kies-Gruben) machen nur 5,9% der Bruthabitate aus. Die mitteleuropäische Rasse L.e. excubitor kann als Kulturfolger gelten; die meisten anderen Raubwürger-Rassen sind eher Kulturflüchter. Bei anderen Lanius-Arten sind nur wenige Steppen-, Halbwüsten- und Wüsten-Bewohner durchweg Kulturflüchter. - Sonderstrukturen: Wald-Landschaften dienen nur in Rand-Zonen (Wald-Lichtung, Waldränder) und meist in Verbindung mit anderen Habitaten, als Raubwürger-Habitat. Feuchtstellen sind bei den meisten Arten; künstliche Warten (Pfosten, Zäune, Masten, Leitungen) nur bei manchen Würger-Arten, und weniger beim Raubwürger, wichtiger Habitat-Bestandteil. Dabei ist die Nutzung von künstlichen Warten vom Angebot an natürlichen Gehölz-Warten abhängig.
6. Kleinstrukturen und Rand-Effekte: In Kultur- wie Natur-Landschaften weisen Raubwürger-Habitate ähnliche charakteristische Kleinstrukturen auf, die sich z.B. bei schwacher periodischer Beweidung oder an Feuchtstellen bilden. So entsteht kleinräumige Struktur-Vielfalt durch Horstgräser bzw. in Horsten wachsende Pflanzen (Abb.48), durch Erdhügel in Form der Ameisenbauten (Abb.50) und Auswurfhäufen von Nagern und durch ein Mosaik von ungleich dicht bzw. ungleich hoch bewachsenen Teilflächen mit Weidepfaden (Abb.58), verursacht durch das Fraßmuster der Weidetiere. Dabei ist die Intensität der Beweidung entscheidend: sowohl bei sehr schwacher bzw. fehlender wie bei sehr starker Beweidung werden die Horstgräser verdrängt und verschwinden die Kleinstrukturen. Die Struktur-Vielfalt in Raubwürger-Habitaten führt im Sommer zu Wuchsdichte-Effekten mit lückig und niedrig bewachsenen Stellen; im Winter zu Ausaper-Effekten mit regelmäßig vorzeitig schneefreien Stellen (Abb.49-54). Durch Wuchsdichte- und Ausaper-Effekte wird für Raubwürger Nahrung leichter erreichbar, insbesondere bei extremer Witterung (Regen bzw. hoher Schnee). Kleinsäuger, Insekten und Spinnen konzentrieren sich teilweise auch winters an den Kleinstrukturen (Rand-Effekt). Ausaper-Effekte treten auch in Wald-Landschaften auf (Abb.56, Abb.57) und können für das Vorkommen von Standvögeln (Eulen, Rauhfußhühner) von Bedeutung sein.
7. Bewirtschaftung und Landschaftsaufbau der Raubwürger-Habitate: Raubwürger-Habitate in traditionellen Kultur-Landschaften weisen räumliche und zeitliche "Lücken der Bewirtschaftung" auf, in denen "verwilderte" Strukturen entstehen können. Durch Nebennutzung der Holzgewächse, wie Brennholz-, Laubheu- und Früchte-Gewinnung (in Hecken-, Moor-Busch- bzw. Streuobst-Landschaften), bleibt die halboffene Grundstruktur des Geländes mit verstreuten Holzgewächsen dauerhaft erhalten. Dagegen führt die heutige Intensiv-Nutzung zu scharfen Bewirtschaftungsgrenzen zwischen gehölzfreien Flächen und geschlossenem Wald. Eine Wieder-Bewaldung der Raubwürger-Habitate wurde traditionell verhindert durch Verjüngung, d.h. Abschlagen, der aufkommenden Gehölze in einem 10 - 20jährigen Rhythmus; so in Moor-Busch- (dort auch durch Abbrennen) und Heide-Landschaften (vgl. Abb.59) oder in Hecken-Landschaften mit Wildhecken auf Steinriegeln (Abb.60) bzw. gepflanzten Wallhecken. In Streuobst-Landschaften, als ortsferne "Obstwälder" (auf ehemaligen Allmenden, Abb.61) oder ortsnahe "Obstgärten" (auf kleinsten Flurstücken, Abb.62), wurden abgehende Bäume nachgepflanzt. Offene Wald-Landschaften werden im heutigen Wirtschaftswald nur an zufällig entstandenen "Wundstellen" zum Raubwürger-Habitat.
8. Zur Evolution der Habitat-Wahl: Die nördliche und die südliche Rassen-Gruppe der Raubwürger scheinen zwei verschiedene Habitat-Typen ('Waldgrenzen' bzw. 'gehölzbestandene Sonderstandorte') zu besiedeln und sich von zwei unterschiedlichen Beute-Gruppen (endotherme bzw. exotherme Tiere) zu ernähren. Auch Unterschiede in der Flügelform lassen sich mit unterschiedlicher Offenheit der Habitate verknüpfen. Daraus wird die Annahme abgeleitet, daß diese Habitat- und Beute-Unterschiede zur Evolution der beiden Rassen-Gruppen geführt haben. Ein Wechsel von endothermer (nördliche) zu exothermer Beute (südliche Populationen) kommt wahrscheinlich auch bei anderen Arten mit breitem Nahrungsspektrum vor. Die bisher oft verwendete Unterteilung in 'Wirbeltiere' und 'Wirbellose' scheint ökologisch weniger aussagekräftig zu sein. Die Habitat-Wahl von L. excubitor (verallgemeinert: die der meisten Lanius-Arten), mit einer Bevorzugung von halboffenen Landschaften, kann sich aufgrund der Verdrängung durch dominante Arten und in Anpassung an Feind-Gefährdung, sowie Wartenjagd und Revier-Anzeigen im Sitzen entwickelt haben. Daher ist Übersichtlichkeit ein entscheidendes Merkmal des Würger-Lebensraumes. Bei der nördlichen Rassen-Gruppe des Raubwürgers kann der jahreszeitliche Habitatwechsel in Anpassung an die Sukzession zum Wald hin entstanden sein.
9. Aussterben des Raubwürgers und Naturschutz
9.1 Der Bestandsrückgang des Raubwürgers in Mitteleuropa lief in zwei Phasen ab: nach großflächiger Räumung von Brutgebieten ab etwa 1960, werden ab etwa 1975 auch "noch intakte" Landschaften aufgegeben. Nur lokal scheinen in jüngster Zeit Bestands-Zunahmen stattzufinden. Als Rückgangsursachen in der zweiten Phase kommen im Gebiet der Südwestlichen Schwäbischen Alb vor allem Habitat-Veränderungen in Betracht: die Einzel-Gehölze und deren Abstände sind zu groß geworden (Baum-Landschaft; Obergrenzen für Grundflächen und Abstände); die Übersichtlichkeit des Geländes ist stark verringert (durch Wald-Aufforstungen und Zunahme der Gehölz-Größen). Mögliche, langfristig wirkende Rückgangsursachen in Mitteleuropa sind: verringerter Bruterfolg in Verbindung mit Nahrungsverknappung und nasskalter Frühjahrswitterung; zunehmende Entfernung zu benachbarten Raubwürger-Revieren (mittlere Abstände 2 - 3 km, Obergrenze bei 4 - 6 km ); zu hoher bzw. zu dichter Bewuchs auch auf Extensiv-Flächen ("Verbrachen") und damit verbunden schwieriger zu erreichende Nahrung; Verdrängung des Raubwürgers in den entstehenden Baum-Landschaften durch größere dominante Arten; und menschliche Störungen (vor allem auf die Hell-Zeit beschränkt), die zur Gefährdung des Nestes und verringertem Jagderfolg führen können.
9.2 Veränderungen von halboffenen, extensiv bewirtschafteten Landschaften betreffen außer dem Raubwürger weitere typische Feldvogel-Arten. Daher sollte der räumliche Aufbau einer Landschaft im praktischen Naturschutz stärker berücksichtigt werden. Um noch vorhandene Extensiv-Gebiete als Raubwürger-Habitate zu erhalten, werden folgende Maßnahmen vorgeschlagen: Neupflanzung von Einzel-Gehölzen in 30 - 100 m Abstand in 100 - 300 m breiten Randzonen von "noch intakten" Gebieten (Abb.63); Verkleinerung von Hecken-Ketten und Baumhecken durch Hecken-Pflege, wobei nur besonders alte, dichte oder Dorn-Büsche (höchstens alle 30 - 50 m ) und besonders alte, krüppelwüchsige oder Totholz-Bäume oder Wildobst- und Beeren-Bäume (höchstens alle 50 - 70 m ) belassen werden sollten (vgl. Abb.64); keine weiteren Nadelholz-Aufforstungen auf Grenzertragsböden in der offenen Feldflur, Schaffen von Sicht-Schneisen in bestehenden Aufforstungen; Unterbrechen von geschlossenen Teerwege-Netzen, lediglich Parallel-Trassen bei neuen Wegen, Erhalt bestehender Erd- und Graswege; Erhalt von Gehölz-"Verwilderungen" (wie Stellen mit verdichtetem Wuchs innerhalb von Bäumen), daher bei Pflege in Streuobst-Landschaften nur Ausschneiden eines jeden 3. Obstbaumes im Wechsel; extensive Beweidung oder Mähen, unterschiedlich häufig auf jahrweise wechselnden Teilflächen; Schutz und Erhalt von noch vorhandenen großflächigen Extensiv-Gebieten (im süddeutschen Raum vor allem von ehemaligen Allmenden) als Reste traditioneller Kultur-Landschaften mit gewachsenem "ökologischem Potential"; Schutz und Erhalt auch von kleinen, "botanisch uninteressanten" Extensiv-Flächen als Teil von halboffenen Gesamt-Landschaften, mit besonderer Bedeutung für Vogel-Arten. Ein Raubwürger-Revier stellt dabei einen volkswirtschaftlichen Wert von wenigstens 2 - 8 x 100.000 Euros dar. Für Streuobst- (Abb.65) und Hecken-Heide-Landschaften (Abb.66) werden die Habitat-Ansprüche des Raubwürgers als Schema dargestellt.
1. Standort, relative Lage und Umgebung von Raubwürger-Nestern im Gebiet der Südwestlichen Schwäbischen Alb: Nester stehen zu etwa gleichen Anteilen in 3 Nestgehölz-Typen: in Obstbäumen (bzw. Laubbäumen i.w.S.), Nadelhölzern und Dornbüschen (Abb.1); im Mittel in 9,65 ± 1,99 m Höhe (Extreme: 1,7 m - 38,0 m, Abb.2), in etwa 2/3 der Gesamthöhe und im Abstand von 2/3 der Breite vom Außenrand zur Mitte des Nestgehölzes (Abb.3) und meist am Innenrand der Blattzone. Nadelholz-Nester (vor allem in Hecken-Heide-Gebieten) liegen meist "oben - innen", Obstbaum- und Dornbusch-Nester (vor allem in Streuobst-Gebieten) tiefer und weiter außen (Abb.3). Nachbargehölze, im Mittel in M= 13,10 m Entfernung und mit nächsten Ästen bis auf M= 6,29 m heranreichend, sind meist höher als das Nest ( M= +1,53 m ). Sichtkontakt-Punkte am Nest sind M= 29,79 m entfernt und ragen M= +4,28 m über Nest-Niveau (Abb.6).
2. Feinstruktur des Nestplatzes: Nester werden durch ±senkrechte Stamm bzw. Ast-Abschnitte oder einen unterhalb liegenden ±astfreien Raum, ebenso wie durch dichte bzw. dornige Beastung des gesamten Gehölzes schwer erreichbar und sind zumindest von oben her durch Belaubung gedeckt. Das Nest selbst kann von dicht-abweisender Beastung umgeben sein und steht meist in "Ast-Verdichtungen" ("Ast-Korb"), mit mehreren Trage- und Stützästen (Abb.4). Zusätzlich kann ein stacheliges Außen-Nest vorhanden sein (Abb.5).
3. Bei den zum Nisten genutzten Gehölzen werden fünf Typen unterschieden: Obstbäume, andere Laubbäume ("Nichtobst-Bäume"), Nadelhölzer, Dornbüsche und nicht-dornige Büsche. Die relativen Häufigkeiten dieser Nestgehölz-Typen sind in anderen Populationen von Lanius e.excubitor in Mitteleuropa ähnlich wie im Gebiet der Südwestlichen Schwäbischen Alb (Abb.1), wobei der Anteil von Nichtobst-Bäumen oft höher ist und die Anteile von Dornbüschen bzw. Nadelhölzern schwanken. Vor 1900 waren Nester in Laubbäumen häufiger, nach 1900 nehmen Nadelholz-Nester zu (vgl. Anhang N1). Bei nördlichen Populationen und Rassen sind Nadelholz-Nester, bei südlichen Rassen (L. [e.] meridionalis sensu lato) Dornbusch-Nester i.w.S. häufiger als in Mitteleuropa (s. Anhang N1, N2). L. senator und L. minor sind in Mitteleuropa ausgeprägtere Baumbrüter als L.e. excubitor; L. collurio ist fast völlig Buschbrüter (Abb.7). Der größte Teil der Würger-Nester in Mitteleuropa steht auf nur wenigen Gehölz-Arten (L.e. excubitor: Kiefer 20,0%, Fichte 18,1%, Birne 9,0%, Eiche 7,4%, Schlehe 6,8% von n= 957; L. senator: Apfel 30,7%, Birne 21,6%, Pappel 21,0% von n= 486; L. minor: Birne 35,9%, Apfel 19,8%, Pappel 10,9% von n= 359; L. collurio: Wildrose 22,3%, Schlehe 17,9%, Brombeere 10,0%, Weißdorn 8,1%, Fichte 11,7% von n= 3290 ). Auch die Nest-Höhen sind in mitteleuropäischen Populationen von L.e. excubitor ähnlich (Zufallsfunde: x= 6,60 ±1,03 m ; gewichtetes Mittel für alle Populationen: x = 8,68 m ), bei großer Spannweite in Einzel-Gebieten. Nördliche und südliche Rassen von L. excubitor haben meist tiefer stehende Nester (gewichtetes Mittel für südliche Rassen L. [e.] meridionalis: x = 1,57 m ; Abb.8). L. senator und L. minor bauen Nester etwa gleich hoch wie L.e. excubitor; L. collurio dagegen in geringerer Höhe (Abb.8). Dabei ergibt sich anhand der gewichteten Mittel eine deutliche Rangfolge der vier Arten (L. minor: x = 6,42 m , senator: x = 4,95 m , collurio: x = 1,34 m ). Der Vergleich der Nesthöhen im gesamten Verbreitungsgebiet des Raubwürgers (Abb.8) zeigt, dass die Habitate an der Nord- und an der Süd-Grenze der Verbreitung ähnlich aufgebaut sind, nach der Höhe der Nest-Gehölze zu schließen. Daher könnte auch die Evolution der beiden Rassen-Gruppen des Raubwürgers in ähnlichen Habitaten, aber unter verschiedenem Klima abgelaufen sein.
4. Nest-Schutzmechanismen sind bei vielen Lanius-Arten ähnlich: möglichst ausgeprägte "Unerreichbarkeit" von unten, "Undurchdringlichkeit" von innen und außen, "Unsichtbarkeit" von außen und oben, ebenso wie die Feinstruktur des Nestplatzes mit Ast-Verdichtungen (vgl. Abb.9). Die einzelnen Schutz-Mechanismen können bei den Nestgehölz-Typen verschieden stark ausgebildet sein. So wird bei L.e. excubitor im SW Alb-Gebiet Sichtschutz in breitkronigen Obstbäumen und Dornbüschen mehr durch "Eigendeckung", in schmalkronigen Nadelhölzern eher durch umstehende Bäume erreicht. L.e. excubitor wählt Nestplätze meist "oben - außen" bzw. "- innen", L. minor "oben - innen", L. senator "mitte -" bzw. "unten - außen" und L. collurio "oben -" bzw. "mitte - außen" im Nest-Gehölz. Bei "Freibrütern" sind die Erfordernisse zum Schutz vor Luftfeinden (möglichst weit innen, möglichst abweisende Nestumgebung), vor Bodenfeinden (möglichst weit oben) und vor der Witterung (möglichst wenig exponiert) oft gegensätzlich. Wenn die Feinstruktur der Nestplätze berücksichtigt wird, ist auch bei "Freibrütern" wie L. excubitor ein Nestplatz-Mangel erkennbar.
5. Wechsel zwischen Nestgehölz-Typen: Mehrfache Brutversuche des Raubwürgers laufen meist ohne Wechsel zwischen Gehölz-Typen ab. Jahreszeitliche Änderungen im "verfügbaren" Nest-Schutz oder Prägung können für einen Wechsel ausschlaggebend sein.
6. Wiederbenutzung von Nestplätzen: Im Gebiet der Südwestlichen Schwäbischen Alb werden 1/10 (1/7) aller Nester( Gehölze) wiederbenutzt, 1/3 aller Brutversuche findet in wiederbenutzten Nestbereichen statt; in Streuobst- häufiger als in Hecken-Heide-Gebieten. Das Nest besteht meist aus drei Schichten: Außen-Nest, Mittelschicht und Innenauskleidung. Insbesondere das Außen-Nest ist länger als 1 Jahr haltbar. Im Jahr vor Wiederbenutzung scheint der Bruterfolg in wiederbenutzten Nestbereichen höher und Verluste fast nur durch Witterung bedingt zu sein. Auch bei anderen L. excubitor-Populationen und anderen Lanius-Arten (vgl. Tab.1) scheinen nur von Nestfeinden verschonte bzw. im Vorjahr erfolgreiche Nestplätze wiederbenutzt zu werden. L.e. excubitor ähnelt darin kleineren Greifvogel- und Eulen-Arten. Wiederbenutzung kann, außer vom Bruterfolg, von verringertem Aufwand für Nestbau, von Veränderungen der Nest-Umgebung und der Konkurrenz durch andere Arten und damit letztlich von Nestplatz-Mangel bestimmt werden.
1. Im Gebiet der Südwestlichen Schwäbischen Alb kommen in Revieren des Raubwürgers Lanius e.excubitor, einer im südlichen Mitteleuropa stark bedrohten Art, weitere vom Aussterben bedrohte oder zumindest regional seltene Arten vor: als Brutvögel (meist 10, bis zu 15 Arten) oder zur Nahrungssuche (6 Greifvogel-Arten; Abb.1). Insbesondere sind darunter auch Feinde und Nahrungskonkurrenten des Raubwürgers (Abb.1). Der Raubwürger kann als Anzeiger (bzw. Leitart) für halboffene, extensiv genutzte Kultur-Landschaften gelten.
2. In Hecken-Landschaften ist das Spektrum der Begleitvogel-Arten vom Alter und Zustand der Steinriegel und Hecken abhängig (Abb.2). In Streuobst-Landschaften nutzen die typischen Arten unterschiedliche Baumbereiche als Nest-Standorte (Abb.3).
Würger Lanius sind bekannt für ihre Ähnlichkeit mit Greifvögeln in morphologischen und Verhaltensmerkmalen; z.B. Schnabel mit Hakenspitze und Zahn (Abb.1, Abb.2); leicht vorstehende Stellung der Augen, die binokulares Sehen erleichtert (Abb.3, Abb.4); und im Vergleich zu 'Läufern' unter den Sperlingsvögeln relativ starke Füße mit großen Sohlenballen an den distalen Zehengliedern (Abb.5); Töten von Wirbeltier-Beute durch Beschädigen der Nackenregion; häufige Nahrungssuch-Methoden, wie Jagd von Warten, im Rütteln, durch Aufscheuchen; "Manteln" über Beute, um sie gegen Artgenossen zu verteidigen; Wiederbenutzung von Stellen zum Zerteilen von größerer Beute; und Hervorbringen von Gewöllen (Abb.6). Unterschiede von Würgern zu Greifvögeln betreffen die Beutebearbeitung, so beim Beutefang (mit dem Schnabel bei Würgern bzw. mit den Füßen bei Greifvögeln); den beim Töten von Beute verwendeten Körperteil (nur mit dem Schnabel bzw. hauptsächlich mit den Füßen); die Art des Zerteilens von größerer Beute (festgemacht an einem Gehölz bzw. in den Füßen gehalten); und das Beutespeichern (in einem Versteck bei Würgern bzw. hauptsächlich im Kropf bei Greifvögeln).
Weniger bekannte Ähnlichkeiten von Würgern mit Greifvögeln stehen in Zusammenhang mit dem Revier-Verhalten (Sichtkontakt-Sitzen; Abb.7) und dem Brut-Verhalten (relativ große, haltbare Nester und teilweise Wiederbenutzung von Nestplätzen; Tab.1 ). Würger unterscheiden sich von Greifvögeln bei anderen Merkmalen des Revier-Verhaltens (Revieranzeigen im Sitzen oder selten durch Sichtkontakt-Hochflüge bei Würgern bzw. im Segelflug bei Greifvögeln) und in der Dauer der Abhängigkeit der Jungen (mit einer relativ langen Bettelflugperiode und einer wahrscheinlich ebenfalls relativ langen Nestlingszeit bei Würgern; Abb.8, Abb.9).
Im Verhältnis zur Körpergröße und im Vergleich zu Greifvögeln scheinen zumindest die großen Würger-Arten einen hohen Nahrungsbedarf aufzuweisen (Tab.2 ). Die zwischenartlichen Beziehungen lassen häufig eine Dominanz von Greifvögeln über Würger erkennen, die zumeist auf Größen-Unterschiede zurückzuführen ist (Abb.10). Daher könnte die Bindung von Würgern an halboffene Lebensräume, mit leichter Übersichtlichkeit in Bodennähe, auch durch die Konkurrenz mit Greifvögeln verursacht sein, welche eine Verdrängung und Gefährdung der Würger zur Folge hat.


Abb.1 Schnabelform bei Würgern Lanius: mit Hakenspitze und Zahn am Oberschnabel und einer entsprechenden Einbuchtung am Unterschnabel; beim ausgewachsenen Vogel: mit geöffnetem Schnabel ( a.1, a.2, b.1, c, d ) und mit geschlossenem Schnabel ( b.2, e.1, f, g, h ); beim fast flüggen Jungvogel: noch nicht voll ausgebildet ( a.3, e.2, i ); a) Raubwürger L. e. excubitor, b) Neuntöter L. collurio, c) Schwarzstirnwürger L. minor, d) Graumantelwürger L. excubitoroides, e) Rotkopfwürger L. senator, f) Maskenwürger L. nubicus, g) Rotschulterwürger L. vittatus, h) Schachwürger L. schach, i) Büffelwürger L. bucephalus. Leicht verändert nach Fotos von lebenden Vögeln, oder nach Fotos von frischtoten und tiefgekühlt konservierten Vögeln (nur b.1, c ); für Einzelnachweise, s. Ökol. Vögel 18, 1996: 177.

Abb.2 Kopf- und Schnabelform bei Würgern Lanius, in Aufsicht von oben: Schnabel zur Spitze hin deutlich verschmälert, Schnabelzahn seitlich leicht vorstehend und so über den Unterschnabel greifend (s. c ); a.1), a.2) Raubwürger L. e. excubitor, b) Neuntöter L. collurio, c) Schwarzstirnwürger L. minor. Leicht verändert nach Fotos von lebenden Vögeln ( a ), oder nach Fotos von frischtoten und tiefgekühlt konservierten Vögeln ( b, c ); für Einzelnachweise, vgl. Abb.1.

Abb.3 Stellung der Augen bei Würgern Lanius: leicht vorstehende Augen, leicht eingesenkte Augenumgebung ( a.1, a.2, b ), Vergrößerung des binokularen Gesichtsfeldes ( a.3, b ); a) Raubwürger Lanius e. excubitor, b) Rotkopfwürger L. senator; zum Vergleich: c) Sperber Accipiter nisus. Verändert nach Fotos von lebenden Vögeln ( a, c aus Schön 1994, b nach Ullrich 1971).

Abb.4 Schädelform bei Würgern Lanius, im Vergleich mit Tag- und Nachtgreifvögeln, in der Aufsicht: deutliche Unterschiede des Schädel-Umrisses, bei etwa gleicher Schädellänge; bei Greifvögeln: hinten stark verbreiterter Schädel mit großem Augen-Abstand und großen Augenhöhlen; bei Würgern: schlankerer Schädel vom 'Singvogel-Typus' mit kleinerem Augen-Abstand. a) Turmfalke Falco tinnunculus, b) Raubwürger Lanius e. excubitor: Schnabelspitze noch mit Teilen der Hornscheide, c) Steinkauz Athene noctua. Maßstab: Linie = 10 mm, Schädel in naturgetreuem Größenverhältnis; am linken und rechten Rand leicht abweichender Blickwinkel (leicht schräg von oben). Nach einem Foto (Präparate Zool. Schausammlung Univ. Tübingen).

Abb.5 Fuß von Würgern Lanius: 'Greifzange' aus Mittel- und Hinterzehe ( a.3, a.4 ), unterstützt durch seitliche Vorderzehen und starke Sohlenballen am Krallenglied ( a.1, a.2, b ), dadurch Verbesserung des Griffes; a) Raubwürger Lanius e. excubitor, b) Neuntöter L. collurio, c) Schwarzstirnwürger L. minor; zum Vergleich: schlanker 'Lauffuß' der Heidelerche Lullula arborea ( d ), nahezu gleich starker 'Klammerfuß' des Fichtenkreuzschnabels Loxia curvirostra ( e ) und bedeutend stärkerer 'Greif-Töter-Fuß' des Mäusebussards Buteo buteo ( f ). Leicht verändert nach Fotos von lebenden Vögeln ( a, b ), von frischtoten und tiefgekühlt konservierten Vögeln ( c ) und Präparaten ( d, e, f ), umgezeichnet auf etwa gleiche Lauf- bzw. Hinterzehen-Länge.

Abb.6 Vergleich der Gewölle von Würger Lanius mit Tag- und Nachtgreifvogel: ähnliche Größe und Form, mit leicht unterschiedlichem Durchmesser, bei deutlich verschieden großen Arten; links: Turmfalke Falco tinnunculus, Mitte: Raubwürger Lanius e. excubitor, rechts: Steinkauz Athene noctua. Maßstab: Linie = 10 mm. Aus Aufsammlungen in SW-Deutschland im Winter und Frühjahr (graue Farbe durch hohen Anteil an Kleinsäuger-Haaren bedingt).

Abb.8 Verhältnis der Entwicklungsdauer n a c h zur Entwicklungsdauer v o r dem Flüggewerden bei Würgern Lanius, im Vergleich zu anderen Sperlingsvögeln und zu Taggreifvögeln und Eulen, bezogen auf die Körpermasse (in g , logarithmische Skala): relative Dauer der Entwicklung nach dem Flüggewerden (bis zum Selbständigwerden der juv.), in bezug auf die Entwicklung vor dem Flüggewerden (= Brut- + Nestlingsdauer). Symbole: ↕ senkrechte Pfeillinien = Spanne des Mittelwertes (häufigste Werte), ⎹ senkrechte dünne Striche = Spannweite der Werte; ● ○ Kreise = Würger Lanius, zumeist mit mehreren Werten für eine Art (s.u.); ● ausgefüllte Kreise = große Stichproben, ○ nicht ausgefüllte Kreise = kleine Stichproben; ▼ Dreiecke = Sperlingsvögel (außer Lanius ), ⧨ Dreiecke mit ausgefüllter linker Hälfte = Offenbrüter unter Sperlingsvögeln von ähnlicher Größe wie Würger (Finken Fringillidae, Grasmücken Sylviidae, Drosseln Turdidae, Ammern Emberizidae ), ⧩ Dreiecke mit ausgefüllter rechter Hälfte = Rabenvögel Corvidae (einschließlich Höhlen- und Nischen-Brütern); ◇ Rhombus = bussard- und habichtartige Taggreifvögel Accipitridae, ⬘ Rhombus mit ausgefüllter oberer Hälfte = Bussarde Buteo, ⬙ Rhombus mit ausgefüllter unterer Hälfte = Habichte, Sperber Accipiter, ⬖ Rhombus mit ausgefüllter linker Hälfte = Weihen Circus, ⬗ Rhombus mit ausgefüllter rechter Hälfte = Geier Aegypius, Gyps, Neophron, etc., ◇ nicht ausgefüllter Rhombus = übrige Accipitridae, z.B. Adler Aquila, Circaetus, Haliaetus, Hieraaetus, Wespenbussard Pernis; □ Quadrate = falkenartige Taggreifvögel Falconidae, ◩ Quadrate mit ausgefüllter oberer, linker Hälfte = Zwergfalken Polihierax, Micrastur, ◪ Quadrate mit ausgefüllter unterer, rechter Hälfte = echte Falken Falco; ⎔ Sechsecke = Eulen Striges (eurasische Vertreter der Gattungen Asio, Athene, Bubo, Glaucidium, Nyctea, Otus, Strix, Tyto). Daten: Lanius: Werte für 8 Arten, mit mehreren Werten für verschiedene Populationen einer Art (L. nubicus 1, L. collurio 4, L. senator 3, L. collaris 2, L. minor 3, L. ludovicianus 3, L. excubitor S- 2, N-group 2, L. sphenocercus 1 Wert-e; übrige Gruppen: nur ein Wert pro Art; für Liste der Arten, s. Ökol. Vögel 18, 1996: 208 (Anhang 8); für Einzelnachweise, s. Ökol. Vögel 18, 1996: 193; Ökol. Vögel 16, 1994: 129.

Abb.9 Dauer der Jugendentwicklung (Tage) bei Würgern Lanius, im Vergleich zu anderen Sperlingsvögeln und zu Taggreifvögeln und Eulen, bezogen auf die Körpermasse (in g , logarithmische Skala): Zeit von Beginn der Bebrütung der Eier bis zur Selbständigkeit der Jungen, d.h. Summe von Bebrütungs- + Nestlingsdauer + Dauer der Bettelflugperiode. Daten: Lanius: Werte für 8 Arten, mit mehreren Werten für verschiedene Populationen einer Art. Symbole, Liste der Arten und Einzelnachweise wie in Abb.8.

Abb.10 Vergleich von Körpergröße ( cm ) und Körpermasse ( g ) bei Würgern Lanius und bei Greifvögeln und Eulen, die in Würger-Habitaten in Europa vorkommen; Umrisse der Arten maßstabsgetreu. Symbole = Mittel von Größe und Masse ("Gewicht"), logarithmische Skala für Masse; ● ausgefüllte Kreise = Würger Lanius, ▼ Dreiecke = Taggreifvögel Accipitres und Falcones, ■ Quadrate = Eulen Striges; nur die häufigsten Arten abgebildet: Würger, Taggreifvögel oberhalb, Eulen unterhalb der horizontalen Achse; Umriss verändert nach verschiedenen Feldführern. Liste der Arten ( * Umriss abgebildet), in der Reihenfolge von links nach rechts: ● Würger: *Lanius collurio, *L. senator, *L. minor, *L. excubitor; ▼ Taggreifvögel: *Accipiter nisus ♂, *Falco tinnunculus, *F. subbuteo, *A. nisus ♀, F. peregrinus ♂, A. gentilis ♂, Pernis apivorus, *Milvus migrans, *Buteo buteo, M. milvus, *F. peregrinus ♀, *A. gentilis ♀; ■ Eulen: *Glaucidium passerinum, Otus scops, *Aegolius funereus, *Athene noctua, *Asio otus, Tyto alba, *Strix aluco.
Die Schwung- und Schwanzfedern eines Raubwürger-Brutvogels Lanius e.excubitor, die von einem der beiden Altvögel eines Brutpaares stammen und in einer Greifvogel-Rupfung gefunden wurden, weisen ausgeprägte Männchen-Merkmale auf (nach Schön 1994a: Abb.1, vgl. Abb.2): - breite weiße Basis der Arm-(und Hand-)schwingen (breiter "Flügelstreif"), - breiter heller Randsaum der Innenfahne der Armschwingen (deutliche "Verbindung Armspiegel - Saumspiegel"), - deutlicher weißer Randsaum auf den Außenfahnen der inneren Armschwingen, - breiter weißer Spitzensaum der Armschwingen (breiter "Saumspiegel"), - hoher Weiß-Anteil auf den äußeren Schwanzfedern. Diese Geschlechtsbestimmung als Männchen wird durch beobachtete Verhaltensunterschiede der Brutvögel und den Fund einer Mauserfeder des überlebenden Vogels gestützt.
Die beiden Subspezies-Gruppen des Raubwürgers ("Nord-Raubwürger" Lanius excubitor sensu stricto und "Süd-Raubwürger" L. [e.] meridionalis sensu lato) unterscheiden sich in Ökologie (Habitate, Beutetier-Gruppen) und Sozialverhalten (Reviergröße, Siedlungsdichte) (Tab.1). Morphologische Unterschiede betreffen, neben dem Zeichnungsmuster des Gefieders (Armschwingen, Jugendgefieder), auch Form von Flügel und Schwanz, Lauflänge und Körpergröße (Tab.1). Es wird versucht, morphologische und ökologische Unterschiede zu verknüpfen. So könnten Flügel- (und Schwanz-) Form zum Habitat-Aufbau, Lauflänge und Schwanz-Stufung zum Beute-Typ in Beziehung stehen.
Die Evolution der beiden Subspezies-Gruppen könnte in zwei unterschiedlichen Großklimaten abgelaufen sein, verbunden mit Anpassungen an unterschiedliche Habitate, Jahreszeiten der Nahrungsverknappung und Beute-Gruppen (Tab.2). Die Parapatrie der beiden Arten bzw. Subspezies-Gruppen könnte durch den geographisch abrupten Wechsel der geeigneten Lebensraum-Typen an einer zonalen Grenze oder durch interspezifische Konkurrenz oder durch beides bedingt sein. Die klinale geographische Reihung der morphologischen Veränderungen von Flügel- und Schwanz-Form innerhalb jeder Subspezies-Gruppe könnte mit Abänderungen des Klimas, d.h. mit der abnehmenden Entfernung zu Ozeanen am westlichen und östlichen Rand des Verbreitungsgebietes, zusammenhängen. Bei einer funktionellen Verknüpfung von morphologischen und ökologischen Merkmalen wird deutlich, dass nicht nur "abgeleitete" (apomorphe), sondern auch "ursprüngliche" (plesiomorphe) Merkmale unter bestimmten ökologischen Bedingungen Selektionsvorteile aufweisen sollten.
In halboffenen Heide-Landschaften sind in jedem Stadium der Heide-Sukzession, abhängig von Größe und Verteilung der Gebüsche und Bäume, andere Vogel-Arten am häufigsten (Abb.22). Neben der Übersichtlichkeit der Gesamt-Landschaft sind dafür auch die kleinräumig wechselnde Beweidungsintensität und die charakteristischen Kleinstrukturen der Horstpflanzen und Ameisenbulte ausschlaggebend. Als Anzeiger (Leitarten) für Heide-Landschaften, die in traditioneller Hütehaltung beweidet werden, sowie lückig-kurzrasig bewachsene und steinige Anfangsstadien und hohe Übersichtlichkeit aufweisen, können Heidelerche und Raubwürger Lanius excubitor gelten (Abb.22). Mit dem Fortschreiten der Heide-Sukzession wechseln auch die Pflanzen-Gesellschaften: von Trockenrasen ("Steintrift") und Magerweide hin zu Kleinbüschen und endlich Kiefern-Fichten-Aufwuchswald.
Durch Aufgabe der Beweidung und Zuwachsen mit Wald sind die Pionierstadien und die daran gebundenen Arten selten geworden. Naturschutz für Heide-Vögel sollte daher vordringlich die Anfangsstadien der Heide-Sukzession fördern. Dies könnte geschehen durch Auflichten von verbuschten Heiden und Wiederöffnen von Aufwuchswäldern, unter Zurückdrängen der Baum-Strukturen, durch Abweiden von flachgründig-steinigen Stellen und durch Schaffung von kleinen Pferchacker-Flächen.
Mit Gehölz-Verteilung und Übersichtlichkeit verändert sich die Zusammensetzung der Vogel-Gemeinschaft in Steinriegel-Hecken-Landschaften. Landschaften mit verschiedenen Stadien der Sukzession, von frisch aufgeworfenen Steinhäufen bis zu waldartigen Baumhecken, werden von unterschiedlichen Vogel-Arten genutzt (Abb.377). Als Anzeiger (Leitart) für Landschaften mit Pionierstadien der Sukzession kann der Steinschmätzer gelten, während die Endstadien der Baumhecken auch von häufigen Waldrand-Vogelarten besiedelt werden (Abb.377). Auch die Pflanzen-Gesellschaften wechseln mit den Stadien der Hecken-Sukzession: von Trockenrasen-Arten der Pionier-Stadien bis zu Wald-Arten der ältesten Stadien.
Durch Aufgabe der traditionellen Bewirtschaftung hat sich das labile Gleichgewicht zwischen Hecken- und Baum-Strukturen in den Steinriegel-Landschaften zu Baum-Strukturen hin verschoben. Dementsprechend sind die Arten der Anfangsstadien der Sukzession selten geworden. Vordringliches Ziel im Naturschutz für Steinriegel- und Hecken-Vögel sollte daher die Förderung von Anfangsstadien der Hecken-Sukzession sein. Dies könnte erfolgen durch die Verjüngung der Hecken unter Zurückdrängung der Baum-Strukturen, die Neuanlage von künstlichen Steinriegeln und die Neupflanzung von Einzelbüschen und Kleinhecken in ausgeräumten Randbereichen.
Für die Feldlerche (Alauda arvensis) sind Kleinstrukturen des Ackerlandes offenbar von großer Bedeutung. In zwei Untersuchungsgebieten (U1, U2) in SW-Deutschland bevorzugte die Feldlerche im Frühsommer Felder mit noch niedrigen Feldfrucht-Sorten, mit 88% (58%) der Reviere auf 35% (33%) der Gesamtfläche von U1 (U2), und mit 3,0 - 3,8 (4,1 - 4,3) Rev./10 ha. Im Vergleich mit Zufallsverteilungen zeigte die Verteilung der Feldlerchen-Reviere eine starke Bevorzugung von "Störstellen" mit lückig-niedrigem Kümmerwuchs, die durch traditonelle Bewirtschaftungsformen (kleinräumige Häufung von Richtungswechseln im Verlauf der Flurstücksgrenzen, Kleinsenken an den Längsseiten von Wölbäckern) oder mikrotopographisch-geologisch (Dolinen, staunasse oder steinige Stellen) bedingt waren; und eine starke Meidung von beliebigen Stellen frei im Feld. Umgekehrt wurden durch moderne Bewirtschaftung bedingte Störstellen (aktuelle Schlaggrenzen, Erdwege) signifikant seltener genutzt als zu erwarten war (Abb.1). Die bevorzugten traditionellen Störstellen entstanden ursprünglich oftmals an Grenzen von kleinräumiger traditioneller Bewirtschaftung, liegen aber heute meistens innerhalb der jetzigen, viel größeren Bewirtschaftungseinheiten und werden überackert. Aus Sicht des Naturschutzes ist zu fordern, dass solche Störstellen als Mosaik von Kleinstrukturen über Acker-Flächen möglichst gleichmäßig verteilt sein sollten.
1. Veränderungen von Halboffen-Landschaften. Bei zahlreichen Halboffenland-Arten vor allem im Kulturland kam es in den letzten Jahrzehnten zu einem starken Bestandsrückgang, so bei Braunkehlchen, Heidelerche, Raubwürger. Am Beispiel des halboffenen Raubwürger-Lebensraumes Lanius excubitor läßt sich erkennen, dass neben den zu großflächigem Rückgang führenden Ursachen, wie: Intensivierung der Landnutzung, Siedlungsausdehnung, Atlantisierung des Klimas, vor allem Veränderungen im Landschaftsaufbau für den weiteren Rückgang in noch intakten Landschaften verantwortlich sein dürften: im ganzen zunehmende Gehölz-Abstände (bei zunehmender Gehölz-Dichte in brachliegenden Bereichen) und zunehmende Gehölz-Größe, Verringerung der Übersichtlichkeit, Zerstückelung der Habitate, zunehmende Dichte und Höhe des krautigen Boden-Bewuchses, Zunahme von Störungen; verbunden mit: dem Verschwinden von verstreuten Gehölzen, Zuwachsen von unbewirtschafteten Teilen mit Wald und dem Wandel von Hecken- in Baum-Landschaften (Tab.1). Dabei ist die Verteilung der Gehölze ("Verstreutheit") vor allem für Wartenjäger entscheidend (Abb.1).
2. Schutz-Ziele. Ausgehend von Untersuchungen im Gebiet der Südwestlichen Schwäbischen Alb werden folgende allgemeine Schutz-Ziele für Halboffen-Landschaften entwickelt (Tab.2): - Erhalt bzw. Wiederherstellung der Übersichtlichkeit und der halboffenen Struktur einer Landschaft, - Erhalt und Nachahmung von traditionellen Nutzungsformen, - Schutz von störungsarmen Bereichen; und folgende Grundsätze für Landschaftspflege abgeleitet (Tab.2): - ökologische Gehölz-Pflege, - Neuschaffung von Kleinstrukturen mit Förderung von Pionierstadien und - ökologische Nutzung von Kleinflächen in Intensivflächen.
3. Landschaftspflege. Diese Ziele sind am ehesten durch folgende Schutz- und Pflege-Maßnahmen erreichbar (Tab.3): (1) an verschiedene Landschaftstypen angepasste, ökologische Gehölz-Pflege, mit Förderung von eher niedrigen Hecken-Strukturen, Zurückdrängen von Baum-Strukturen und Schonung von schwachwüchsigen Gehölzen und Astverdichtungen (Krüppelwuchs) (Tab.4); im Einzelnen so durch: - ökologische Hecken-Pflege (Abb.3) mit Verjüngen von Baumhecken, - Heide-Pflege (Abb.6) mit Wiederöffnen von Aufwuchswäldern und Auflichten von dichter Heide, - Streuobst-Pflege (Abb.11) mit Baumschnitt in wechselnden Gruppen und Stützen von Alt-Obstbäumen, - Moor-Pflege mit Auflichten von Bruchwald-Aufwuchs; (2) Neuschaffung von Kleinstrukturen nach traditionellen Vorbildern; wie - Anlage von künstlichen Steinriegeln (Abb.13, Abb.14) an übersichtlichen Geländestellen und aus grobem erdfreiem Stein-Material, mit einer Abdeckung aus groben Steinen und mit einer abgerundeten Form; und - Pflanzung von Einzel-Gehölzen (vgl. Abb.1), möglichst verstreut und aus niedrig bleibenden Gehölz-Arten; (3) extensive Beweidung, z.B. Hüte-Schafbeweidung mit Pferchacker, und extensive Wiesen-Nutzung, z.B. Mehrfach-Streifen-Mahd (Abb.19) mit wechselnden Brache-Streifen. - Die bisherige Verwirklichung dieser Maßnahmen (Umsetzung) im Gebiet der SW-Alb zeigt bereits Erfolg: in insgesamt 14 Teilgebieten fand auf > 60 ha eine ökologische Gehölz-Pflege statt und es wurden 90 Steinriegel errichtet (Tab.5). Die Pflege-Flächen wurden sowohl vom Raubwürger, entweder fortgesetzt genutzt, wiedergenutzt oder sogar neubesiedelt, wie auch von anderen Halboffenland-Arten rasch angenommen (Tab.6); insbesondere wurden künstliche Steinriegel von > 22 Arten genutzt (Tab.7).
4. Landschaftszustand und -schutz. Mit der hier vorgeschlagenen Schutz-Konzeption wird versucht, auf Grundlage von Beobachtungen an langjährigen Vorkommen von Halboffenland-Arten, Gundsätze für Schutz und Pflege von Halboffen-Landschaften, ihrer Kleinstrukturen und Lebensgemeinschaften abzuleiten. Der Schwerpunkt von Schutz-Maßnahmen sollte abhängig vom Zustand einer Landschaft sein: in offeneren Hecken-Landschaften kann Grünland-Bewirtschaftung ausreichend, in dichteren Baum-Landschaften Gehölz-Pflege vordringlich sein. Eine ökologisch ausgerichtete, extensive Grünland-Nutzung sollte sich durch niedrig-lückig bewachsene Teilbereiche, in kleinräumigem Wechsel mit höher-dichter bewachsenen Bereichen auszeichnen. Dies kann in (Halb-) Offen-Landschaften in Wiesen durch ungleichzeitige Streifen-Mahd und in Weiden durch schwache Beweidung (auch Waldweide) erreicht werden.
5. Kleinstrukturen des Ackerlandes. Auch in offenen Acker-Landschaften finden sich Kleinstrukturen, die auf Bewirtschaftungslücken von traditionellen Bewirtschaftungsformen zurückgehen, so Störstellen mit Kümmerwuchs an Grenzsenken von Wölbäckern, an Treppwegen, an Anwändern, über Dolinen oder an steinigen Stellen (Abb.21, Abb.22). Solche Kleinstrukturen könnten neu geschaffen werden: - durch Kleinacker-Bewirtschaftung (Abb.23) mit kleinflächig und kurzzeitig wechselndem Umackern von Streifen und - durch Anlage von Feuchtacker-Kleinstellen (Abb.24) mit künstlich verdichtetem Boden auf möglichst kahl zu haltenden Stellen. Die Verteilung dieser Kleinstrukturen ist für Feldvogel-Arten von Bedeutung. So liegen die Brutbereiche (Revierzentren) von Feldlerche Alauda arvensis und Wachtel Coturnix coturnix häufig in Nähe solcher 'Störstellen mit Kümmerwuchs' (Abb.21, Abb.22). - Kleinäcker mit Hackfrucht-Anbau, wechselnden Feldfrüchten und bloßem Boden können bevorzugte Nahrungsflächen sein für Würger Lanius, Steinkauz Athene noctua, Wiedehopf Upupa epops (Abb.23).
6. Bewirtschaftungslücken und Pionierstadien. In Halboffen-Landschaften besteht ein "labiles Gleichgewicht" zwischen Hecken- und Baum-Strukturen, das in der traditionellen Kultur-Landschaft durch eine Nebennutzung der Holzgewächse (Brennholz usw.) aufrecht erhalten wurde. Dabei siedelten sich die Holzgewächse in Bewirtschaftungslücken an, die sich (bis auf die Nebennutzung) weitgehend selbständig zu Kleinstrukturen entwickeln konnten ("verwildern") und durch die sich kleinräumig-extensive traditionelle Bewirtschaftungsformen auszeichneten (Tab.8). Im Gegensatz dazu werden bei heutiger Intensiv-Bewirtschaftung die halboffenen Übergangsbereiche durch scharfe Bewirtschaftungsgrenzen zwischen Wald und Feld ersetzt. Weil auch eine Nebennutzung der Holzgewächse ausbleibt, ist das labile Gleichgewicht der Gehölze heute stark zu Baum-Strukturen hin verschoben und die Pionierstadien der Gehölz-Sukzession sind selten geworden. Dementsprechend sind die Tierarten der Pionierstadien des Halboffenlandes heute ebenfalls bestandsgefährdet (Hecken-: Abb.25, Heide-Landschaften: Abb.26).
7. Schutz eines Naturraumes. Ein großflächiger Schutz für Halboffen-Landschaften sollte Feld- und Wald-Teillandschaften bzw. Reste der traditionellen Kultur- und der Natur-Landschaft im Rahmen einer Schutz-Konzeption für einen Naturraum als Ganzes erfassen. Besonderheiten des Südwest-Alb-Gebietes, die den Schutz erleichtern, sind: das Vorkommen von natürlichen Kiefern-Fichten-Aufwuchswäldern (Alb-Hochfläche, Abb.27), von ortsfernen ausgedehnten Streuobst-Wäldern (Alb-Vorland) und von größeren Flächen mit Wölbäckern, weiterhin halboffene, übersichtliche Kuppen und Talränder und die große Gesamtfläche der Halboffenland-Bereiche. Eine Schutz-Konzeption für den Naturraum des Südwest-Alb-Gebietes sollte daher vor allem den halboffenen Feld-Lebensraum des Raubwürgers umfassen, mit Heide-, Steinriegel-Hecken- und Streuobst-Landschaften, und den halboffenen, stufigen Wald-Lebensraum des Haselhuhns Bonasa bonasia, mit Steilhang-Wäldern des Traufes und der Täler am Alb-Nordrand. Im Südwest-Alb-Lebensraum beider Arten kommen zahlreiche weitere im Bestand gefährdete Tier- und Pflanzen-Arten vor.
8. Traditionelle Vorbilder. Bei der Neuschaffung von Kleinstrukturen den traditionellen Vorbildern folgend, sollten künstliche Steinriegel an erhöhten Geländestellen angelegt werden (flachgründig-steiniger Boden, verringerte Boden-Einschwemmung), nahe an Acker-Flächen und mit großen oberflächennahen Hohlräumen zwischen den Steinen. Dabei wird eine Umkehrung der natürlichen Größensortierung der Steine, wie sie traditionell duch Auslesen von großen Steinen aus Äckern zustande kommt, bei künstlichen Steinriegeln erst durch zusätzlichen Aufwand erreicht (Aufbringen einer Haube aus großen Steinen; vgl. Abb.14). Durch die genaue und oft aufwendige Nachahmung der traditionellen Kleinstrukturen (als verlässliche Vorbilder) wird die Nutzung durch Halboffenland-Arten begünstigt, z.B. für Steinschmätzer Oenanthe oenanthe (Brüten an übersichtlichen Stellen, in großem Hohlraum, Nahrungssuche an kurzrasig-lückig bewachsenen Stellen).
9. Dynamik der Vegetation. In Halboffen-Landschaften des Kulturlandes, deren Aufbau in Zentraleuropa zumeist lediglich künstlich, in einem scheinbar statischen Zustand, aufrecht erhalten werden kann, laufen vor allem in Bewirtschaftungslücken Veränderungen in Teil-Sukzessionen ab. Erst das Mosaik dieser Teilzustände, welches regelmäßig künstlich erneuert werden muss, setzt sich zu einem schützenswerten Lebensraum zusammen (vgl. Abb.25, Abb.26). Falls vom heutigen Landschaftszustand aus eine sich selbst überlassene Entwicklung einsetzen würde, wäre zudem dieser Ausgangspunkt ein gegenüber natürlichen Verhältnissen stark gestörter Zustand (z.B. bedingt durch nichtheimische Tier- und Pflanzen-Arten, mit wenigen Massen-Arten). Insbesondere die Pionierstadien sind im heutigen Landschaftszustand verkürzt bzw. selten und sollten deshalb gefördert werden.

Abb.1 Zur Bedeutung von verstreut stehenden Einzel-Gehölzen: Warten-Verteilung und nutzbare Fläche für Raubwürger und andere vom Ansitz jagende Vogelarten: drei Stadien bei der Veränderung einer halboffenen Modell-Landschaft (Aufsicht); linke Bildhälfte: 25 dicht stehende Gehölze im Abstand a ; rechte Bildhälfte: Stadium 1: +10, Stadium 2: +5, Stadium 3: +1 verstreut stehende Gehölz-Warte(n) im Abstand 2a ; Zahlen: Anteil der nutzbaren Gesamtfläche (Stadium 1: 100%); schwarze Punkte = Gehölze, schraffierte Kreise = Fläche, die von einer Warte aus im Ansitz bei Beutestößen nutzbar ist (bei der Mehrzahl der Beutstöße). Maßstab entspricht etwa den Verhältnissen im halboffenen Raubwürger-Lebensraum. Leicht verändert aus Schön 1994.

Abb.3 «Ökologische Hecken-Pflege» in Hecken-Landschaften am Beispiel einer hochgewachsenen Steinriegel-Hecke ('Baumhecke'), in drei Stadien: 1 Zustand vor der Pflege: überalterte Baumhecke, mit seitlichem Busch-Gürtel ("Mantel") und Baumstreifen in der Mitte, Lesesteinriegel nur noch an wenigen Stellen sichtbar; 2 unmittelbar nach Hecken-Pflege: Bäume entfernt (Baumstümpfe), Sträucher meist 'auf Stock gesetzt', wenige Büsche belassen, Steinriegel freigelegt; 3 wenige Jahre nach Pflege: Stock-Ausschlag der meisten Sträucher wieder zu einer Hecke aufgewachsen, einzelne Bäume im Schutz der größten Büsche nach oben dringend, Steinriegel an zahlreichen Stellen noch gehölzfrei; jeweils linkes Teilbild: Schmalseite ("Querschnitt"), jeweils rechtes größeres Teilbild: Aufsicht von der Längsseite; Zeichen: punktiert und gestrichelt umrandet = Steinriegel, Lesesteinwall (leicht überhöht), Horste = Wurzelstöcke der Sträucher, unregelmäßig begrenzte Umrisse = Holzgewächse (Kronenhöhe der größten Bäume etwas verringert), schräg schraffiert = bei der Pflege belassene Gehölze; Schnitt leicht überhöht; Maßstab: Achsen-Einteilung in m . Leicht verändert aus Schön 1994.

Abb.5 «Ökologische Hecken-Pflege» an einer überalterten Steinriegel-Hecke: Verjüngung der großen Bäume ('Auf-den-Stock-Setzen'), Belassen von wenigen kleineren Bäumen und Büschen (hinten-links), Steinriegel teilweise wieder freigelegt (helle Steine: vorne-Zentrum). Selbst Baumarten des Hochwaldes wachsen auf traditionellen Steinriegeln mit Stockausschlägen (helle Schnittflächen der "Stammbündel" einer Buche Fagus sylvatica: vorne). Ast-Material teilweise noch nicht abgeräumt (Mitte-rechts); Zustand 4 Monate nach herbstlicher Pflege. Im Hintergrund: weitere parallele Reihen von Steinriegel-Hecken mit Bäumen (hinten-rechts, von der Schmalseite), Zustand meist wie vor Pflege; Hochwald-Rand (hinten-links). >18 Jahre besetztes Raubwürger-Brut- und Winter-Wohngebiet "Alte Greuten-Stockäcker", Hochfläche der Südwestlichen Schwäbischen Alb. Foto 4.4.1995.

Abb.6 «Ökologische Heide-Pflege» in Heide-Landschaften am Beispiel einer Wacholderheide (jeweils linke Hälfte) und eines Aufwuchswaldes (jeweils rechte Hälfte), in drei Stadien: 1 Zustand vor der Pflege: verbuschte Wacholderheide (links, 'Buschheide') mit sich zusammenschließenden Gebüsch-Gruppen und überalterter Baumhecke, diese mit seitlichem "Mantel" von Kleinbüschen und Baumstreifen in der Mitte; Kiefern-Fichten-Aufwuchswald (rechts) mit mehrkronigen älteren Bäumen in der unteren und wüchsigen jüngeren Bäumen in der oberen Kronenschicht, im Unterstand mit Jungbäumen und absterbenden Dorn- und Beeren-Sträuchern ('Ausdunkeln'); Bodenoberfläche: Gehölze häufig an steinigen Stellen, oft auf Lesesteinriegeln, die überwachsen sind; Erdhügel (aufgegebene Ameisenbauten); 2 unmittelbar nach Heide-Pflege: in der Wacholderheide (links) meiste Gebüsche entnommen ('auf den Stock gesetzt'), Jungbäume entfernt, wenige Einzelbüsche belassen; im Aufwuchswald (rechts) wüchsige Bäume aus oberster Kronenschicht und Unterstand entnommen, wenige schwachwüchsige, mehrkronige Bäume (hier: Kiefern) und kleinere Sträucher belassen; steinige Stellen freigelegt; kurze Baumstümpfe (0,5 - 1,5 m hoch) stehend belassen; 3 wenige Jahre nach Pflege: Stock-Ausschlag der Sträucher an einigen Stellen wieder zu Gebüschen aufgewachsen, belassene Bäume wenig vergrößert, steinige Stellen großenteils noch gehölzfrei, Krone des Einzelbaumes teilweise geschädigt (Wind, Eis). Zeichen: Kleinsthügel mit Kringelmuster = steinige Stellen bzw. Lesesteinriegel, unregelmäßig begrenzte Umrisse = Gehölze, säulenartiger Umriß = Wacholder, schräg schraffiert = bei der Pflege belassene Gehölze; Schnitt leicht überhöht; Maßstab: Achsen-Einteilung in m .


Abb.9 (oben-links) Wiedergeöffneter Teil eines Kiefern-Fichten-Aufwuchswaldes nach «ökologischer Heide-Pflege»: Entnahme der meisten Bäume (Baumstümpfe: Mitte-links, -rechts), Belassen von einzelnen schwachwüchsigen, oft mehrkronigen Bäumen (Kiefern: Mitte, hinten-rechts) und von wenigen Büschen (vorne-links, auf Steinriegel; hinten-rechts), Freilegen eines ehemaligen Steinriegels (helle Steine: vorne); Zustand 1,5 Jahre nach herbstlicher Pflege. Angrenzend: halboffene Wacholderheide (hellbräunliche Grasfärbung: hinten-links) und geschlossener Aufwuchswald (hinten-rechts) im Zustand wie vor Pflege. >30 Jahre besetztes Raubwürger-Wohngebiet "Dürrs Feld", Hochfläche der Südwestlichen Schwäbischen Alb. Foto 10.4.1997.
Abb.10 (oben-rechts) Wiederbeweidung einer wiedergeöffneten Fläche in einem ehemaligen Kiefern-Fichten-Aufwuchswald, im Zustand 4 Jahre nach der letzten «ökologischen Heide-Pflege»: zahlreiche Heide-Pflanzen im wiederbeweideten Bodenbewuchs (z.B. Büschel der Horstgräser: Mitte-rechts), bereits ähnlich wie auf traditionellen Heiden; belassene Büsche wieder vergrößert (vorne-links), belassene Bäume wieder mit abgerundeten Formen (Mitte-links, -rechts), Baumstümpfe noch sichtbar (vorne-ganz rechts). Durchblick auf angrenzende Heide-Kuppe (hinten), Bäume (Mitte) auf Höhe des Außenrandes des ehemaligen Aufwuchswaldes. >16 Jahre besetztes Raubwürger-Wohngebiet "Kuhwasen", Hochfläche der Südwestlichen Schwäbischen Alb. Foto 24.10.1996.

Abb.11 «Ökologische Streuobst-Pflege» in Streuobst-Landschaften, in drei aufeinanderfolgenden Stadien in Abständen von 5 Jahren: Baumschnitt mit weitgehendem Erhalt von Kleinstrukturen (Nistmöglichkeiten für Frei- und Höhlenbrüter, tote Bäume), Nachpflanzung von Obstbäumen und Streifen-Mahd der Wiesen; dabei jeweils ein Drittel der Bäume mit Baumschnitt gepflegt und zwei Drittel ungepflegt belassen (punktierte Linie = Umriß der ursprünglichen Baumform vor der Pflege). Teilbilder zeigen jeweils dieselbe Baumreihe: Zustand 1 (oben): Bäume A, D, E frisch gepflegt (beschnitten), übrige Bäume ungepflegt-"verwildert" belassen, Baum B absterbend; Zustand 2 (Mitte): Bäume F, I, J frisch gepflegt, Bäume A, D, E wieder dichter beastet (neue Triebe), Bäume C, G, H weiterhin ungepflegt und noch "verwilderter", Baum B als stehendes Totholz belassen ("Baumruine"); Zustand 3 (unten): Bäume C, G, H frisch gepflegt, Bäume F, I, J wieder dichter-neu beastet, Bäume A, D, E noch dichter beastet und "verwildert" wie in Zustand 1, Totbaum B weiter abgeastet-zerfallend und stehend belassen, Jungbaum als Ersatz für B nachgepflanzt. Symbole in Kreisen = erhaltenswerte Kleinstrukturen in den Bäumen: △ aufrechtes Dreieck = Ast-Verdichtung ('Astkorb'-Bildung), ▽ auf der Spitze stehendes Dreieck = Mistel Viscum album oder 'Hexenbesen' (Pilzbefall), ◎ Doppelkreis = größere Stamm- oder Ast-Höhlen. Wiesen-Unternutzung der Flächen zwischen den Bäumen: in «Mehrfach-Streifen-Mahd» an wechselnden Stellen, mit Hochstauden-'Saumstreifen' an Grenzen und mit lang- und kurzrasigen, d.h. seltener und häufiger gemähten Teilflächen (Dreistrich = langrasig, Stoppel = kurzrasig). Obst-Sorten: Birne: D, F, H, J; Apfel: A, B, C, E, G, I. Skala in m . Nach Fotos von Obstbäumen im Gebiet von Südwest-Alb und Oberem Neckarland.

Abb.12 Erhalt von altem Hochstamm-Obstbaum (Apfel) in traditioneller Streuobst-Landschaft: Eisenspange an bruchgefährdeter Stamm-Gabelung als traditionelle Methode ('Astklammer' an 'Gabelkrone'). Schutz eines abgestorbenen Stammteiles mit Bruthöhle der Weidenmeise Parus montanus, gleichzeitig weiterhin gesicherter Früchte-Ertrag im gesunden Teil der Baumkrone. "Pfaffenhalde", Trauf-Fuß der Südwestlichen Schwäbischen Alb. Foto 1.6.1984.


Abb.13 Neu-Anlage von künstlichen Steinriegeln - mögliche Stellen für das Aufschütten von Stein-Häufen im Blockbild. Aufsicht: 1 auf Gelände-Rippen, 2 am Rand von breiteren Gelände-Erhebungen bzw. Plateaus; 3 traditionelle Lesesteinriegel an der Oberkante des Steilhanges, mit Gebüschen überwachsen; 4 zwischen Gebüschen an der Unterkante des Steilhanges. Schnitt: an den Gelände-Rippen: härtere Gesteinsschichten an die Oberfläche tretend, dort aufgeackerte Steine ('Steinfelder'); in den Senken: weichere Gesteinsschichten unter mächtiger, z.T. eingeschwemmter Boden-Schicht liegend. Aufgeschüttete Stein-Häufen auf aus der Nutzung ausgesparten bzw. nur extensiv genutzten Streifen. Leicht gewölbter Hügel mit steil abfallenden Rändern, Gelände-Rippen etwa senkrecht zu den Höhenlinien verlaufend, Acker-Nutzung etwa parallel zu den Höhenlinien. Stein-Häufen stark vergrößert. Symbole: in der Aufsicht: mit unregelmäßigen Strichel-Linien = Acker-Flächen (Schollen-Linien), locker punktiert = extensiv genutzter Streifen mit Stein-Häufen, Kringel-Muster = Stein-Häufen, unregelmäßig begrenzte Flecken = Gebüsche; im Schnitt: gemauerte Musterung = härtere Gesteinsschichten (Massengestein, Steinmergel), schräg schraffiert = weichere Gesteinsschichten (Tone, Mergel), schwarz = Boden. Schematisches Blockbild, Anschnitt nach vorne verschoben.
Abb.14 Neu-Anlage von künstlichen Steinriegeln - Aufschütten und Nachbessern von Stein-Häufen in Acker-Gelände, in zwei Phasen: 1 Aufschüttung unmittelbar nach Abladen der Steine vom Kipperfahrzeug: Steinhaufen abgeflacht, Steine verstreut liegend ("herabgekullert"), Steine oft in labiler Lage, dabei größere Steine eher unten und weiter entfernt zu liegen kommend, kleinere Steine eher obenauf und dicht am Schüttpunkt (Schüttung von der rechten Seite her); angrenzend: abgeernteter Stoppelacker; 2 nach der Nachbesserung des Steinhaufens (von Hand, mit Ladefahrzeug): abgerundete, in sich geschlossene Form und größere Höhe des Steinhaufens, schützende haltbare Abdeckung ("Haube"), große oberflächennahe Hohlräume, dabei größere Steine obenauf geschichtet, verstreute Steine eingesammelt; Umrandung mit Sand-Schicht; angrenzend: umgepflügter Acker (rechts). Zeichen: schraffiert = Oberfläche des gewachsenen Bodens, Kringel darin = im Boden eingebettete Steine aus anstehendem Gestein, unregelmäßige Formen darüber = aufgeschüttetes, nahezu erdfreies Stein-Material, fein punktiert = bodenfreies Feinmaterial (hier: 'Steinsand'). Maßstab: Skala in m . Halbschematischer Schnitt.


Abb.16 (oben-links) Anlage von Steinhäufen, verbunden durch niedrige Steinwälle, und Umrandung mit Steinsand-Schicht ("Sandfuß"): letztes Stadium eines schrittweisen Aufbaues von künstlichen Steinriegeln auf Brachestreifen in einer Acker-Landschaft mit Rain-Hecken und Wacholderheide. Zustand nach Nachbesserung: Schichtung der Steinriegel von Hand ausgebaut, Steinsand-Schicht verdichtet ('Mineralbeton'); Steinhäufen bis zu 2 Jahre alt, Wälle und Sandschicht neu. Hintergrund: parallele Reihe von künstlichen Steinriegeln. Herkunft des Materials: zumeist behauene römische Mauer-Steine ('Handquader', etwa 150 n.Chr., Muschelkalk) aus einer archäologischen Grabung, und Steinsand aus Muschelkalk-Steinbruch. Gleiches Gebiet wie Abb.17. >6 Jahre besetztes Raubwürger-Winter-Wohngebiet "Hungerbühl", Vorland der Südwest-Alb. Foto 19.9.1997.
Abb.17 (oben-rechts) Acker-Landschaft mit künstlichen Steinriegeln, in Form von zwei Reihen von Steinhäufen auf Brachestreifen, angrenzend an Rain-Hecken und Wacholderheide: großenteils aus behauenen römischen Mauer-Steinen aus einer archäologischen Grabung, ergänzt durch Lesesteine aus den Äckern (= weiße Steine auf dem Haufen vorne-links, Gipskeuper); Schichtung der Steinhäufen nach dem Aufschütten von Hand nachgebessert. Aufgeackerte Steine in den Feldern sichtbar (Mitte-rechts, hinten-links der Mitte). Im Hintergrund: Wacholderheide (hinten-rechts), Kiefern-Aufforstungen auf ehemaliger Heide (Horizont-nach links), davor: zweite Reihe von Steinhäufen. Gleiches Gebiet wie Abb.16. >6 Jahre besetztes Raubwürger-Winter-Wohngebiet. Foto 12.3.1997.


Abb.19 Schema der «Mehrfach-Streifen-Mahd» einer Wiese, mit Wechsel von gemähten und ungemähten Streifen innerhalb eines Flurstückes (bzw. einer Bewirtschaftungseinheit): wechselnde Zustände in aufeinanderfolgenden Jahren (Vegetationsperioden), bei über 1,5 Vegetationsperioden hinweg andauernder Brache ('Zeitbrache'); unterschiedliche Größe der Brache-Anteile: I Gesamtes Flurstück einbezogen (Brache-Teilfläche wandert über das Flurstück hinweg), II Brache-Streifen auf Randzonen des Flurstückes beschränkt; Zustände: Zahlen 1 , 2 , 3 = 1., 2., 3. Jahr (= Vegetationsperiode); Buchstaben a , b = Sommer (a) bzw. Herbst (b) des Jahres ( 1a = 1. Sommer ); Zustand jeweils unmittelbar nach einer Mahd; Brache: N = neu ausgeschiedene, nicht gemähte Brache, B = diesjährige, hochgewachsene Brache, A = vorjährige Altbrache, die erst spät im Jahr wieder gemäht wird. Schematischer Schnitt.

Abb.20 «Streifen-Mahd» von Feuchtwiesen in einer Talauen-Landschaft: Belassen von 1 - 2 m breiten ungemähten Zeitbrache-Streifen an den Grenzen von schmalen Flurstücken (hellbräunliche Altgras-Streifen vom Vorjahr; einzelne Hochstauden: vorne-rechts, Mitte-rechts vom Zentrum). Schwach gedüngte, 1-2schürige Mähwiesen zwischen den Streifen (helle Punkte = blühendes Wiesen-Schaumkraut Cardamine pratensis). Brut-Bereich des Braunkehlchens Saxicola rubetra, das die Hochstauden als Warten nutzt; Raubwürger-Winter-Wohngebiet. Ammertal, mittleres Neckarland. Foto 20.4.1997.


Abb.21 Traditionelle Kleinstrukturen des Ackerlandes und Feldlerchen-Vorkommen Alauda arvensis in einer (halb-)offenen Feld-Landschaft: flache Feucht-Senken an Flurstücksgrenzen ('Wölbäcker') und besondere Flurstücksformen (quer zueinander verlaufende Gruppen von Flurstücken: 'Anwander') im Vorland der Südwestlichen Schwäbischen Alb (Bildäcker, Trillfingen); heute in intensiv bewirtschafteten Getreidefeldern liegend, die über mehrere Flurstücke hinwegreichen, und teilweise überackert; Zustand unmittelbar vor der Flurbereinigung. Häufung der Feldlerchen-Brutplätze nahe an diesen Kleinstrukturen.
Oben, Foto: flache Geländemulde (s. Schnitt, unten), nach hinten (NE) zu in größeres Muldensystem einmündend. Zustand zur Haupt-Vegetationszeit, mit Getreide (Gerste: vorne - nach links, Sommergerste: vorne - rechter Rand) bzw. Hackfrucht (Kartoffel) im Hochstand. 11.7.1997.
Mitte, Karte (Aufsicht): traditionelle Flurstücksgrenzen, die heute oftmals überackert sind, wenn mehrere kleinflächige Flurstücke (meist schmale 'Handtücher') als Bewirtschaftungseinheit genutzt werden. Dicke gestrichelte Linien = Blickausschnitt, Dreieck = Standort für Foto (oben); Pfeile mit Buchstaben = Lage des Schnittes A - B (unten); annähernd parallele Linien = Grenzen von Flurstücken, dünn gestrichelte Linien = heute überackerte Flurstücksgrenzen, durchgezogene dünne Linien = heutige Bestandsgrenzen (Grenzen heutiger Bewirtschaftungseinheiten); doppelt punktierte Linie mit kleinen Pfeilen = Wassergraben. Kleinstrukturen: 1 = kleinräumige Häufung von starken Richtungswechseln im Verlauf der traditionellen Flurstücksgrenzen ( 1 = im Gelände auffällige 'Störstelle', 1' = anhand der Karte erschlossene 'Störstelle'), 2 = 'Grenzsenken' in Form von feucht-staunassen Kleinsenken an traditionellen Flurstücksgrenzen, 3 = durch geologische Gegebenheiten bedingte 'Störstellen', wie quellig-staunasse Stellen oder Dolinen-Einbrüche ( = punktiertes Oval), 4 = nicht ausgebauter 'Treppweg' (historisches Überfahrtsrecht außerhalb der Bewirtschaftungszeit). Brutplätze der Feldlerche (Revierzentren): ▽ nach unten zeigende Dreiecke = Bruten 1995 (nur in Abb.22), ◇ Rauten = frühe Bruten 1996, □ Quadrate = späte Bruten 1996, ○ Kreise = späte Bruten 1997 (Reviere nach dem 1.6. ), ⎔ waagrechte Sechsecke = frühe Bruten 1998, ⬡ auf Spitze, senkrecht stehende Sechsecke = späte Bruten 1998, ◁ nach links zeigende Dreiecke = frühe Bruten 1999, ▷ nach rechts zeigende Dreiecke = späte Bruten 1999, ⦵ Kreis mit waagrechtem Strich = frühe Bruten 2000, ⦶ Kreis mit senkrechtem Strich = späte Bruten 2000. Grundlage: Aufnahmen des Feldlerchen-Bestandes 1997-2000 (M. Schön) und 1995-1996 (H. Hermann). Maßstab: Rand-Einteilung in 100 m - Abschnitten.
Unten: halbschematischer Schnitt A - B, 50fach überhöht, über die gesamte Breite des Karten-Ausschnittes: schmale schlitzförmige Einschnitte = Senken an traditionellen Flurstücksgrenzen ('Grenzsenken'), durch traditionellen Ackerbau entstanden ('Zusammenwurf' der Schollen in 'Wölbäckern'); Geländemulden zu Staunässe neigend (Lehmauflage über Gipskeuper und verkarstetem Muschelkalk); Geländeausbildung ohne durch aktuelle Bewirtschaftung bedingte Unebenheiten (ohne Ackerfurchen o.ä.). Richtung des Schnittes: ungefähr senkrecht zur Blickrichtung des Fotos. Maßstab: Skala in m , gleicher Längen-Maßstab in Flurkarte (Mitte) und Schnitt (unten). Karte in Abb.21 (Mitte): hier ergänzt mit zusätzlichen Daten, die in der publizierten Fassung in Ökol. Vögel 22, 2000: 196 nicht enthalten sind.


Abb.22 Traditionelle Kleinstrukturen des Ackerlandes und Feldlerchen-Vorkommen Alauda arvensis in einer (halb-) offenen Feld-Landschaft: Dolinen, flache Senken an Flurstücksgrenzen ('Wölbäcker') und besondere Flurstücks-Kleinformen (Dreiecke, 'Anwander') im Vorland der Südwestlichen Schwäbischen Alb (Gurgel, Imnau); heute in ausgedehnten, intensiv bewirtschafteten Getreidefeldern liegend, die über mehrere Flurstücke hinwegreichen, und überackert; Zustand unmittelbar vor der Flurbereinigung. Häufung der Feldlerchen-Brutplätze an diesen traditionellen Kleinstrukturen. Oben, Foto: Doline (Bildmitte hinten) auf flacher Kuppe gelegen, nach S zu (linker Rand) breite flache Geländemulde anschließend (s. Schnitt, unten). Zustand zur Haupt-Vegetationszeit, mit Getreide (Weizen) im Hochstand. 11.7.1997. Mitte: Karte (Aufsicht). Unten: Schnitt. Übrige Zeichen wie Abb.21. Karte in Abb.22 (Mitte): hier ergänzt mit zusätzlichen Daten, die in der publizierten Fassung in Ökol. Vögel 22, 2000: 199 nicht enthalten sind.

Abb.23 Nachahmung von traditionellem Hackfrucht-Anbau durch ökologisch ausgerichtete «Kleinacker-Bewirtschaftung» am Rand eines Streuobst-Bestandes: mit Umackern von wechselnden Streifen in kurzzeitigem Rhythmus. Zustand 1 (oben): traditionelle Hackfrucht-Kleinäcker ('Feldgärten') mit kleinräumig wechselnden Feldfrucht-Sorten: a = Runkelrübe Beta vulgaris var. rapa, b = Getreide (Weizen Triticum aestivum, Gerste Hordeum vulgare), c = Kopfkohl ("Kraut") Brassica oleracea var. capitata, d = Möhren Daucus carota ssp. sativus, e = Stangenbohnen Phaseolus vulgaris var. vulgaris an Stangen, f = Lauch Allium porrum, g = unbebauter, bloßer Streifen mit Feldsalat Valerianella locusta var. oleracea, h = Zwiebeln Allium cepa var. cepa, i = Kartoffeln Solanum tuberosum, j = Wiese (hier: langrasig belassen), k = Hochstamm-Obstbaum am Rand eines Streuobst-Bestandes, mit Stammhöhlen (oben: in altem Astansatz, unten: in Wundschlitz). Zustand 2 (unten): Nachahmung durch «Kleinacker-Bewirtschaftung»: A = frisch geackerter Streifen (Schollen), B = vor 1 - 2 Wochen geackerter Streifen (keimende Wildkräuter), C = vor 3 - 5 Wochen geackerter Streifen (niedrige Wildkräuter, z.T. blühend), D = Streifen mit Getreide (z.B. Weizen, Gerste, Dinkel Triticum spelta, Roggen Secale cereale), E = kurzzeitige Brache, mit Wildkräutern lückig bewachsen und mit eingebrachter Stange (Sitzwarte), F = Hochstauden-Saumstreifen am Wiesenrand (im letzten Jahr belassen), G = Wiese am Baum, mit wechselndem lang- und kurzrasigem Teil, k = s.o. Schnitt, 4,3fach überhöht (dabei Pflanzen in natürlicher Form abgebildet). Skala in m .

Abb.24 Anlage von «Feuchtacker-Kleinstellen» mit lückig-niedrigem Bewuchs in feucht-staunassen Bereichen in offenem Ackerland: schematischer Schnitt von zwei Landschaftszuständen in einer flachen Geländesenke mit wenig wasserdurchlässigem Untergrund. A Traditionelle Acker-Bewirtschaftung: Grenzen an den Längsseiten der Flurstücke liegen in kleinen Eintiefungen ('Grenzsenken'), die durch Pflügen zur Flurstücksmitte hin entstanden ('Zusammenwurf' der Schollen in 'Wölbäckern'), und um durch das System der 'Grenzsenken' großflächige Vernässung zu verhindern; staunasse Bereiche nur in Jahren mit trockener Witterung genutzt. 1 'Grenzsenken' von 'Wölbäckern' (Flurstückslängsrichtung quer zur Bildebene), 2 quelliger, zeitweise staunasser Bereich, in trockenen Jahren bebaut (Flurstückslängsrichtung parallel zur Bildebene), 3 feuchter Acker-Streifen in den tiefsten Teilen der Senke, nur in trockenen Jahren bebaut, 4 Flachmoor-Streifen (Bulte von Seggen Carex) an Quellbach (Wassergraben). B Ökologisch ausgerichtete Nutzung von «Feuchtacker-Kleinstellen» bei heutiger Acker-Bewirtschaftung: feucht-staunasse Stellen mit lückig-niedrigem Bewuchs und bloßem Boden von Intensiv-Bewirtschaftung ausgenommen (z.B. bei Flurneuordnung). 1' erhaltene 'Grenzsenken', 2' erhaltene quellige «Feuchtacker-Kleinstelle» (feuchtester Teil von 2 ), nur extensiv genutzt, am Rand mit künstlich verdichtetem Boden ( = Kreuzschraffur), durch Pfluggräben abgegrenzt von der intensiv genutzten Ackerfläche, 5 «Feuchtacker-Kleinstelle» in staunassen Teilen der Senke, mit durch Walzen künstlich verdichtetem Boden ( = Kreuzschraffur), nur extensiv genutzt, 6 Hochstauden-Saumstreifen (Kurzzeit-Brache) in trockenen Bereichen (Kuppe). Schnitt 25fach überhöht, Randskala in m . Zustand bei Getreide-Hochstand, ohne bewirtschaftungsbedingte Unebenheiten (ohne Ackerfurchen o.ä.).
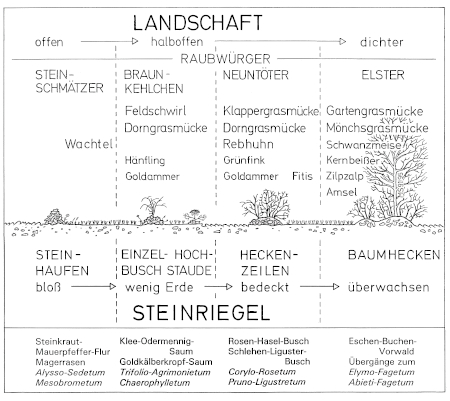
Abb.25 Charakteristische Vogel-Arten in verschiedenen Altersstadien der 'Hecken-Sukzession' in Steinriegel-Hecken-Landschaften im Gebiet der Schwäbischen Alb (links: Pionier-, rechts: Klimaxstadien der Sukzession): Aufbau der Landschaft, Schwerpunkt des Vorkommens (oben), Alter und Größe der Steinriegel bzw. Gehölze (Mitte, untere Hälfte) und Pflanzengesellschaften (unten). Nach langjährigen Untersuchungen vor allem im Bereich der Südwest-Alb. Leicht verändert aus Schön 1994.
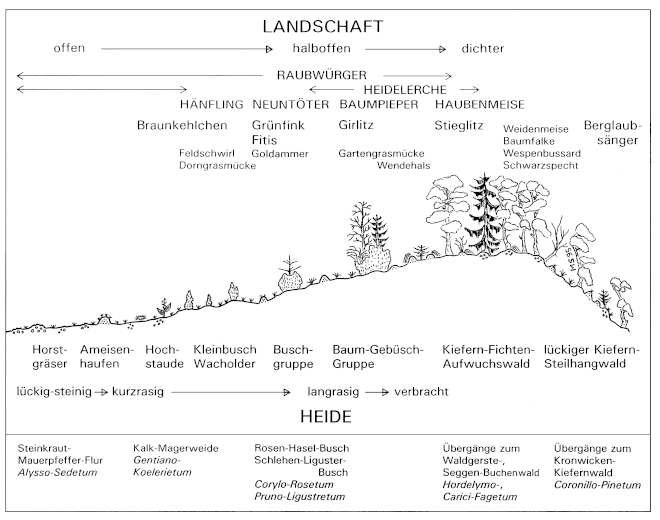
Abb.26 Charakteristische Vogel-Arten in verschiedenen Altersstadien der 'Heide-Sukzession' in Wacholderheide-Landschaften im Gebiet der Schwäbischen Alb (links: Pionier-, rechts: Klimaxstadien der Sukzession): Aufbau der Landschaft, Schwerpunkt des Vorkommens (oben), Alter und Größe von Kleinstrukturen bzw. Gehölzen (Mitte, untere Hälfte) und Pflanzengesellschaften (unten). Nach langjährigen Untersuchungen vor allem im Bereich der Südwest-Alb.
1. Wesentliche Gefährdungsursachen für die Brutbestände der Wachtel in Mitteleuropa beruhen auf der Intensivierung der landwirtschaftlichen Nutzung der Feld-Landschaften in Zentraleuropa, mit flächendeckender Bewirtschaftung, kürzeren Bewirtschaftungsrhythmen, Vergrößerung der Bewirtschaftungseinheiten (Schlaggrößen), Verminderung der Sorten-Vielfalt und massivem Biozideinsatz. Dies führt zu einer Verringerung des Nahrungsangebotes und zur Beseitigung von Kleinstrukturen in Acker- und Wiesenland. Solche von Feldvögeln bevorzugt genutzten Kleinstrukturen sind als Gelände-Kleinformen durch traditionelle Bewirtschaftungsformen und / oder durch geologische Gegebenheiten entstanden und bilden "Störstellen" mit meist lückig-niedrigem Bewuchs ("Bewirtschaftungslücken"). Bei Intensivierung der Nutzung werden sie beseitigt (durch Überackern, Verfüllen usw.). Daneben trägt die direkte Verfolgung durch den Menschen (Fang, Jagd) zur Gefährdung bei, ebenso wie klimatisch bedingte Veränderungen in Brutgebieten (stärker atlantisches Klima) und Wintergebieten (Ausdehnung der Trockenperioden in der Sahelzone).
2. Damit ergeben sich folgende Grundsätze für den Schutz der Art: 2.1 Erhalt von noch vorhandenen traditionellen Kleinstrukturen, durch Erhalt von Gelände-Kleinformen mit Kümmerwuchs ("Störstellen"), so - in Acker-Gelände: an Kopfenden von kleinteiligen Flurstücken (Anwander, Mißformen, Treppwege) als steinige Stellen, an Längsseiten von schmalen Flurstücken als Kleinsenken (bei Wölbäckern); - in Wiesen-Gelände: als zeitweise staunasse Kleinsenken (nach Schneeschmelze, Starkregen, Überschwemmungsrinnen) oder als flachgründige Trockenstellen (ungedüngte Magerrasen-Flecken). - Erhalt von unbewirtschafteten Kleinflächen in Feldern, mit Einzelbüschen, Kleinhecken, Einzelbäumen an Geländeabsätzen, an staunassen oder steinig-trockenen Stellen. Dabei: Erhalt der Übersichtlichkeit der Gesamt-Landschaft, durch Förderung der Pionierstadien der Sukzession von Offenland zu Wald. 2.2 Erhaltung und Nachahmung von traditionellen Bewirtschaftungsformen, so - in Acker-Gelände: Erhalt von kleinflächig wechselnder Sorten-Vielfalt (kleine Schläge mit wechselnden Kulturen); - in Wiesen-Gelände: Erhalt eines kleinflächigen Wechsels des Mäh-Musters (unterschiedlich häufige, zeitlich versetzte Mahd). - Nachahmung von traditionellen Nutzungsformen, durch: - ökologische Nutzung von Kleinstellen (möglichst kleinräumige, ungleichzeitige, extensive Bewirtschaftung); - ökologische Feldgehölz-Pflege (Förderung von Hecken-Strukturen, Zurückdrängen von Baum-Strukturen, Verringerung der Gehölz-Höhen). 2.3 Neuanlage von Kleinstrukturen: - mit der Möglichkeit zur selbständigen Entwicklung in zeitweiligen "Bewirtschaftungslücken" (in Gebieten mit noch vorhandenen traditionellen Kleinstrukturen, in störungsarmen Zonen von Wegen entfernt); - verteilt-verstreut über große Flächen (z.B. in Abständen von 30 m - 100 m ). - Verringerung der Intensität der Landnutzung in Gebieten mit (noch) großen Wachtel-Beständen, so durch Beschränkung des Dünger- und Biozid-Einsatzes.
3. Einzelne Schutz- und Pflege-Maßnahmen umfassen vor allem die Neuanlage von Kleinstrukturen und dürften so am wirkungsvollsten sein. 3.1 Neuanlage von Feuchtacker-Kleinstellen (vor allem) in Acker-Gelände: durch künstliche Verdichtung des Bodens (Walzen nach Pflügen), in bereits vernässten Bereichen. Dadurch können feucht-staunasse, zeitweise überschwemmte Kleinflächen mit lückig-niedrigem Bewuchs entstehen. 3.2 Neuanlage von künstlichen Steinriegeln vorzugsweise in Acker-Gelände: in Form von aufgeschütteten Steinhäufen und -wällen (mit 2 - 4 m Durchmesser und 0,5 - 1,5 m Höhe, aus je 3 - 7 t grobem, bodenfreiem Gesteinsmaterial), an herausragenden Punkten (Gelände-Kuppen, obere Hangkanten), in Bereichen mit flachgründig-steinigen Böden. 3.3 Mehrfach-Streifen-Mahd in Wiesen-Gelände: mit kleinräumigem Wechsel von gemähten und (zeitweise) ungemähten Streifen, durch Staffelung der Mahd auf wechselnden Teilflächen (mit jährlich mehrfacher Mahd auf kurzrasigen Teilflächen und zeitweiliger Brache, über wenigstens 1,5 Jahre hinweg, auf langrasigen Teilflächen). 3.4 Erhalt und Neuanlage von Brache-Kleinflächen innerhalb von Feldern: mit zeitweilig ruhender Bewirtschaftung und abschnittsweiser Mahd oder Beweidung, zwischen oder am Rand von Flurstücken (Zwickel, Saumstreifen). 3.5 Neupflanzung von niedrigen Klein-Gehölzen in Feldern, wobei Pionierstadien gefördert und möglichst lange erhalten werden sollten: durch Pflanzen von Einzelbüschen und Kleinhecken (anstatt von Heckenzeilen) und von Streuobst-Einzelbäumen und -Kleingruppen (anstatt von hochwüchsigen Baumstreifen).
Erratum zu Schön (2001): Wachtel - Gefährdungsursachen und notwendige Schutzmaßnahmen, p.107
Im Text auf S.107 (rechte Spalte, Absatz unterhalb der Mitte) ist das Wort "Markungsgrenzen" verschoben. Richtig muss es heißen (Änderung kursiv):
"Auf unbewirtschafteten Kleinflächen in Feldern: Erhalt von verstreut stehenden Gehölzen, so von: - Einzelbüschen, Hecken, Einzelbäumen an Geländeabsätzen, an staunassen oder steinigen Stellen (Raine, Steinriegel, Zwickel, an Flurstücksrändern, Allmende- und Markungsgrenzen); - dabei: Erhalt der Übersichtlichkeit der Gesamt-Landschaft durch Förderung der Pionier-(Anfangs-)stadien der Sukzession von Offenland zu Wald (s. Schön 1997: 319f.)."
An einer Ackerland-Population der Feldlerche Alauda arvensis konnte in vier Brutperioden (1997-2000) in zwei Untersuchungsgebieten in SW-Deutschland gezeigt werden, dass die Feldlerche im Frühsommer Felder, und innerhalb der Felder Kleinflächen, mit relativ niedrigem Bewuchs bevorzugte. So lagen die Revierzentren in der mittleren wie in der späten Brutzeit bevorzugt in Feldern mit erst spät hochwachsenden, noch niedrigen Feldfrucht-Sorten (Tab.1).
Innerhalb der Felder zeigte die Verteilung der Revierzentren der Feldlerche durchgängig: (1) eine starke Bevorzugung von Kleinflächen mit lückig-niedrigem Bewuchs, die durch traditonelle Bewirtschaftungsformen oder geologisch bedingt waren (traditionelle Störstellen mit Kümmerwuchs); (2) umgekehrt eine Meidung von durch moderne Bewirtschaftung bedingten Störstellen und von beliebigen Stellen frei im Feld (Abb.3, Tab.2). Etwa 4/5 aller Feldlerchen-Bruten fanden an traditionellen Störstellen statt; 1/3 der genutzten traditionellen Störstellen wurde mehrfach genutzt.
Die Feldlerche bevorzugte relativ kleine Felder (von weniger als 3 ha Schlaggröße), wo sich auf nur 10-20% der Fläche 46-64% der Reviere, in Dichten bis zu 13,6 R/10 ha, fanden (1999). Die Siedlungsdichte schwankte in beiden Gebieten etwa parallel (mittlere Brutzeit: 2,7 - 5,5 R/10 ha; späte Brutzeit: 2,1 - 4,2 R/10 ha ).
Der Lebensraum der Feldlerche muss sowohl lückig-niedrig bewachsene Nahrungsflächen wie dichter-höher bewachsene deckungsreiche Nistbereiche aufweisen, wobei sich Bewuchshöhe und -dichte jahreszeitlich ändern. Dabei kommt den durch traditionelle Bewirtschaftung oder geologisch bedingten Störstellen mit lückig-niedrigem Bewuchs als Kleinstrukturen des Ackerlandes offenbar besondere Bedeutung für Feldvögel zu. Traditionelle Störstellen, die oft an Grenzen von kleinräumiger traditioneller Bewirtschaftung entstanden, werden bevorzugt, obwohl sie meist innerhalb der heutigen Bewirtschaftungseinheiten liegen und überackert werden. Aus Naturschutzgründen sollten daher traditionelle Störstellen erhalten oder vergleichbare Kleinstrukturen, in einer Dichte von 1 - 2 Stellen / ha, neu angelegt werden.
Die Fähigkeit zu Fliegen ist ein herausragendes Merkmal von Vögeln. Während aber bei Bewegungsabläufen die Veränderungen im morphologischen Gefüge genau bekannt sind, erfahren die damit verknüpften Änderungen der optischen Signale, die durch die Gefieder-Zeichnung der Vögel erzeugt werden, kaum Aufmerksamkeit. Die meisten Studien und Abbildungen sind auf statische Situationen hin ausgerichtet: von sitzenden Vögeln oder von mit starr ausgebreiteten Flügeln fliegenden Vögeln. Wenn aber die Fähigkeit zu aktivem Flug miteinbezogen wird, dann erscheinen zwei Annahmen zwingend: - Vögel sollten dynamische Signalmuster zeigen, die sich periodisch mit der Flügelbewegung ändern; - Vögel sollten zur Verständigung viel eher dynamische optische Signale als statische Markierungen einsetzen.
Beim Entfalten und Falten des Flügels (und des Schwanzes) während des aktiven Fluges können Zeichnungsmuster, die zum übrigen Gefieder kontrastieren, ein aufblitzendes Signal erzeugen (Modelle in Fig.1 - Fig.3). Der Kontrast kann durch "Einrahmung" noch verstärkt sein. So können bei einer Flügelstreif-Zeichnung, die beim Fliegen periodisch "aufgedeckt" wird, hellere Flächen durch dunklere Bereiche von Fahne oder Schaft "eingerahmt" sein (Bsp. in Fig.4, Fig.5). Die Wahrnehmung von dynamischen Signalen wird durch deren Komplexität erschwert, da sich Größe, Form und Ausrichtung während der Bewegung verändern (vgl. Fig.1, Fig.2). Zudem kann es sein, dass das vollständige Signalmuster nur für wenige Millisekunden sichtbar ist (vgl. Fig.3). Die Auffälligkeit von dynamischen optischen Signalmustern kann durch ein rasches An- (Auf-) und Abschalten (Abdecken), d.h. durch "Aufblitzen", noch gesteigert sein.
Die Entstehung von kontrastreichen Zeichnungsmustern kann die mechanische Stabilität der Federn verringern. In der Evolution sollten daher durch natürliche Selektionsvorgänge diese Nachteile (Kosten) gegen die Vorteile (Nutzen) der Signal-Wirksamkeit ausbalanciert werden. Die Zeichnung der Vögel sollte unter verschiedenen Gesichtspunkten erklärt werden: vor dem natürlichen Umgebungshintergrund, auf verschiedenen Ebenen von der Einzelfeder bis zum gesamten Vogel (vgl. Fig.4 - Fig.6) und beim sich bewegenden Vogel. Für dynamische optische Signale fehlen quantitative Betrachtungen bislang weitgehend. Zudem könnten bei Vögeln dynamische optische Signalmuster auch in für das menschliche Auge nicht sichtbaren Bereichen des UV verbreitet sein.
Um den Rückgang von Feldlerchen-Populationen zu verlangsamen, werden in Landwirtschaft-Naturschutz-Programmen oft Kleinstrukturen mit niedrig-lückigem Bewuchs innerhalb der Felder (als "Flecken", "Trittsteine", "Fenster") jeweils für eine Vegetationsperiode künstlich angelegt. Andererseits können derartige Kleinstrukturen mit Kümmerwuchs (als Mikrohabitat-Strukturen) in Ackerland auch von selbst natürlicherweise entstehen und über lange Zeiträume erhalten bleiben, so bedingt durch mikrotopographisch-geologische Gegebenheiten und/oder durch traditionelle Bewirtschaftungsformen. Die Feldlerche, ebenso wie andere Arten der Feld-Ökosysteme, können sehr eng an solche Kleinstrukturen gebunden sein. In zwei Untersuchungsgebieten in SW-Deutschland, mit relativ hohen Dichten von 0,26 - 0,42 Feldlerchen-Revieren / ha, waren 80,2% der Revier-Zentren in der Nähe von solchen "natürlichen" Kleinstrukturen gelegen und 34,2 % dieser "natürlichen" Kleinstrukturen wurden in verschiedenen Jahren wiederholt genutzt.
In Verbindung mit Beobachtungen zu weiteren Ackerland-Arten, z.B. Arthropoden, an diesen Stellen wird hier verallgemeinernd die Vorstellung (Hypothese) vorgebracht, dass kurzlebige Kleinstrukturen mit Kümmerwuchs überwiegend Arten mit kürzeren Lebenszyklen begünstigen, wohingegen die langlebigen, von selbst entstehenden "natürlichen" Kleinstrukturen auch vorteilhaft für Arten mit höherer Ortstreue oder mit mehrjährigen Lebenszyklen sein dürften.
In vielen Gebieten sind solche "natürlichen" Kleinstrukturen mit Kümmerwuchs - zumindest in Spuren und oft übersehen - bis heute vorhanden. Sie verschwinden aber beschleunigt durch den Einsatz von modernen agroindustriellen Maschinen. Dadurch werden diese Kleinstrukturen zunehmend weniger wirkungsvoll als "Störstellen" und im Verursachen von fleckenhaftem Kümmerwuchs. Deshalb könnte der Schutz von solchen "natürlichen", quasi selbsterhaltenden und daher i.e.S. nachhaltigen Kleinstrukturen (Mikrohabitat-Strukturen), die an lokale Bedingungen angepasst sind, die Arten-Vielfalt erhalten und vergrößern helfen. Weitere Untersuchungen sind nötig, um die ökologische Bedeutung dieser immer noch unterschätzten Bestandteile von Ackerland-Ökosystemen besser zu verstehen.
Beim Ziegenmelker Caprimulgus e. europaeus tritt ein 'Augenleuchten' auf: die Vögel zeigen im Auflicht (Blitzlicht einer Kamera, Anstrahlen mit Lampe) "leuchtende Augen" von z.T. intensiv golden-rötlicher Farbe, was allerdings nur aus bestimmtem Blickwinkel erkennbar wird ("Aufleuchten" der Augen beim "Herschauen" des Vogels) (Abb.1, Abb.2).
Das 'Augenleuchten' ist auch von anderen Schwalmvogel-Arten Caprimulgi bekannt, kommt aber offenbar nur in wenigen weiteren Vogel-Gruppen vor (wenige Eulen Striges, Strauß Struthio; s. Tab.1). Es kommt durch eine hinter der Netzhaut liegende Reflexionsschicht, 'Tapetum lucidum', zustande (Abb.3, Abb.4), die das Sehvermögen bei geringer Helligkeit verbessern hilft und die für mehrere Nachtschwalben-Arten belegt und demnach auch für C. europaeus anzunehmen ist.
Auch von anderen Wirbeltier-Gruppen sind 'Augenleuchten' und 'Tapetum lucidum' bekannt (Abb.5), wobei die Reflexionsschicht verschiedene Teile der Augenwand (Choroidea, Pigmentepithel der Retina) umfassen und verschieden aufgebaut (Fibrillen, Kristallplättchen) sein kann. Daher dürfte ein 'Tapetum lucidum' - als Anpassung an Sehen bei geringen Helligkeiten - in der Stammesgeschichte mehrfach unabhängig entstanden sein. Bei Schwalmvögeln Caprimulgi lassen sich als Anpassungen an Dämmerungs- bzw. Nacht-Lebensweise sowohl morphologische Merkmale (große Augen, große Pupille und Reflexionsschicht, große Mundspalte, samtig-weiches Gefieder, "lautloser" Flug) wie Verhaltens-Merkmale (Beute-Anflug gegen helleren Hintergrund, Erhöhung bzw. Kopplung von Aktivität und Brüten mit dem Mondzyklus) verstehen.
Beobachtungen an einem freilebenden Grünspecht-Männchen Picus viridis, dessen Steuerfedern fehlten und der daher ohne stützenden Schwanz kletterte, werden dokumentiert (Abb.1 - Abb.6). Das Männchen beteiligte sich in diesem Zustand am erfolgreichen Bau einer neuen Bruthöhle. Der stützschwanzlose Specht hielt den Körper relativ dicht an der Stamm-Unterlage (Abb.7). Von einer starken Abnutzung und / oder Verkürzung bzw. Beschädigung der Steuerfedern bei freilebenden Spechten, insbesondere bei Grün- und Grauspecht P. viridis, P. canus, wird auch in der Literatur berichtet. Dabei scheinen auffällige Einschränkungen der Bewegungsmöglichkeiten kaum vorzukommen.
Ein kletternder Vogel ist Zug- und Druckkräften und veränderlichen Hebelwirkungen (Drehmomente) ausgesetzt. Beim Klettern mit Schwanz dienen die Füße vor allem zum Festhalten und der Schwanz zum Abstützen bzw. Abstandhalten; beim Klettern ohne Schwanz werden Vorderzehen bzw. oberer Fuß vor allem als Halt und Hinterzehe(n) bzw. unterer Fuß als Stütze eingesetzt (Abb.8). Daher müssen bei einem ohne Stützschwanz kletternden Specht die Hinterzehen die Belastung des Schwanzes mitübernehmen. Die nach hinten ausrichtbare, relativ lange Außenzehe (IV, Wendezehe) der Spechte wie auch die im Mittel geringere Beanspruchung des Schwanzes bei Erdspechten, wie dem Grünspecht, dürften eine solche erhöhte Belastung des Fußes nach Verlust des Schwanzes leichter möglich machen.
1. Der für Eulen typische Gesichtsschleier ist nur der sichtbare Teil der im Gefieder verborgenen schallempfangenden Strukturen des äußeren Ohres. Bei Jungvögeln mit noch wachsendem Gefieder sind weitere Einzelheiten erkennbar: - die Gesichtsfedern, die strahlenförmig um das Auge herum als trichterförmige Vertiefung angeordnet sind (Abb.1); - die eigentlichen Schleierfedern, die wie Schuppen in dichten Reihen übereinander liegen und das Eulengesicht nach hinten-außen begrenzen; die Schleierfedern bilden in jeder Gesichtshälfte eine hohlwannenförmige, hochovale "Federmuschel", welche etwa senkrecht zur Sehachse steht (Abb.1, Abb.3); - der an den Seiten nach hinten ausgebuchtete Schleier, der das angelegte Kopfgefieder seitlich überragt (Abb.3); - die Ausrichtung der Gesichts- und Schleierfedern auf ein Zentrum etwas unterhalb-hinter dem Auge: nämlich auf die äußere Ohröffnung hin (Abb.2, Abb.3), welche nach Vorschieben der Gesichtsfedern sichtbar wird (Abb.4) und bei der Schleiereule links etwas höher als rechts liegt.
2. Die Schleierfedern stehen auf einer das Gesicht umrandenden Hautfalte hinter der äußeren Ohröffnung (postaurale Falte); sie besitzen feste, dicht geschlossene Fahnen und einen spitzenwärts S-förmig gebogenen Schaft und damit eher schallreflektierende Eigenschaften. Die Gesichtsfedern sitzen verteilt über das Gesicht und auf einer Hautfalte vor der Ohröffnung (praeaurale Falte, Ohrdeckel); es sind sperrig-lockerästige, borstenartige Federn ohne geschlossene Fahne und damit eher schalldurchlässig (Abb.6, Abb.7).
3. Die beiden Schleier-Federmuscheln bilden offenbar Paraboloid-Schallreflektoren, mit der Ohröffnung im Brennpunkt (Abb.6, Abb.7), welche eine genauere Ortung von Schallquellen erlauben (Richtungshören). Zwischen der Ausbildung des Schleiers, Lebensraum und Aktivitätszeit lässt sich ein Zusammenhang ableiten: - nachtaktive Eulenarten in dichten (Wald-) Lebensräumen und/oder Arten, die sich von rasch beweglicher, hohe Laute ausstoßender Beute (Kleinsäuger) ernähren, besitzen einen stärker ausgebildeten Schleier und jagen eher nach Gehör; - eher dämmerungs- oder tagaktive Eulenarten in offeneren Lebensräumen und/oder Arten, die von kleiner, sich langsam bewegender, stummer Beute leben, besitzen einen wenig ausgeprägten Schleier und jagen vor allem nach Sicht.
4. Das äußere Ohr weist bei einigen Eulenarten eine Links-Rechts-Asymmetrie auf, die sich auf die häutig-fleischigen Teile beschränken oder die knöchernen Schädel-Vorwölbungen des Ohres mitumfassen kann. Diese Asymmetrie hilft, die Ortungsgenauigkeit im Raum, vor allem in der Senkrechten (Vertikale), zu verbessern. Sie ist damit vorteilhaft für Arten, die von erhöhten Warten aus bodenlebende Beute nach Gehör jagen.


Abb.6 Halbschematischer Blick von oben auf den Kopf einer Schleiereule, mit Schleier und Schädel in natürlicher Haltung der aufrecht sitzenden Eule; zusätzlich eingezeichnet: Hautfalten und Federn des Schleiers in einer waagerechten Ebene auf Höhe der Augen. 1 Schleierfedern (äußerer Teil), 2 äußere Gesichtsfedern, 3 vordere praeaurale Hautfalte (Ohrdeckel), 4 hintere postaurale Hautfalte, 5 äußere Ohröffnung, 6 Lage des Trommelfells (im Schädelinnern), 7 Fortsetzung der postauralen Hautfalte (Ansatzstelle) auf der Schädeloberseite (gestrichelt), 8 Umriss des Gesichtsschleiers (Spitzen der längsten Schleierfedern) nach unten und unterhalb des Schnabels (punktiert), 9 innere Gesichtsfedern (Zügelbefiederung), 10 innere Schleierfedern, 11 Oberschnabel, 12 Augapfel mit Ring aus knöchernen Plättchen (Skleroticalring), 13 Hals (Umriss mit Muskeln und Haut). Kombiniert nach Dementiew & Iljitschew 1963, D. Meinertzhagen in Pycraft 1898, Nitzsch 1840, Schwartzkopff 1962, sowie nach Photos und Präparaten.
Abb.7 Halbschematische Seitenansicht einer Schleiereule: Kopfbereich mit Schleier und Schädel in natürlicher Haltung der aufrecht sitzenden Eule; Kopf etwas weniger nach vorne geneigt wie in Abb.6; zusätzlich eingezeichnet: Hautfalten und Schleier. OA Seh- und Hörachse (optische Achse), SB Ebene von Schädelbasis und Gaumendach; 3 praeaurale Hautfalte: Ansatzstelle auf dem Schädel, 4 postaurale Hautfalte: Ansatzstelle auf dem Schädel, 7' Fortsetzung der postauralen Hautfalte (Ansatzstelle) nach unten hin auf Unterkiefer und Kehle (gestrichelt), 8 Umriss des Gesichtsschleiers: voll ausgebreitet nach der Seite, 8' Umriss des Schleiers in der Gesichtsmitte zwischen den Augen, 14 Unterschnabel, 15 Hornschnabel-Scheide; übrige Bezeichnungen wie Abb.6. Kombiniert nach D. Meinertzhagen in Pycraft 1898, Norberg 1978, Pycraft 1903, sowie nach Photos und Präparaten.
1. Das Züngeln eines freilebenden, fast flüggen Jungvogels des Wendehalses Jynx torquilla wird dokumentiert (Abb.1 - Abb.5). Das Betasten der nächsten Umgebung mit raschen, gerichteten Zungen-Bewegungen kurz vor dem Ausfliegen ist außer vom Wendehals auch von anderen Specht-Arten bekannt und gehört auch bei Altvögeln offenbar zum normalen Nahrungssuch-Verhalten. Die außerordentlich lange Zunge des Wendehalses weist eine glatte verhornte Spitze auf (Abb.10) und ist ca. 40 mm weit vorstreckbar (Abb.7). Das weite Vorstrecken der Zunge wird möglich durch die starke Verlängerung der hinteren Teile des Zungenskeletts (Zungenbeinhörner) und der daran ansetzenden Muskeln (Vorzieher M. geniohyoideus = M. branchiomandibularis): die Zunge reicht in einer Schlaufe den Hals hinunter ('Halsschlinge') und um den Schädel herum bis in den Oberschnabel (Abb.8, Abb.9).
2. Bei Spechten lassen sich morphologische Merkmale mit ökologischen Bedingungen, d.h. Lebensweise und -raum, in Beziehung setzen. Am Boden nahrungssuchende Arten, die sich vor allem von Ameisen ernähren ( 'Erdspechte', wie Jynx torquilla, Picus viridis ), und an waagrechtem, morsch-weichem Astholz nahrungssuchende Arten besitzen mehr oder minder stark ausgeprägt: - eine relativ lange Klebe-Fangzunge, mit wenigborstigeer oder glatter verhornter Spitze und große Speicheldrüsen ('Leimrute', vgl. Abb.8 - Abb.11), - einen relativ schlanken, schmalen Stocher-Wühl-Schnabel, am relativ schmalen, länglichen Schädel, - Hüpf-(Klammer-)beine mit relativ großer Fußspanne und - einen leicht spreizbaren Flugsteuer-Schwanz. Demgegenüber zeigen an senkrechtem Stammholz kletternd-hackend nahrungssuchende Arten ( 'Kletter-Hackspechte', wie Dendrocopos, Picoides, Dryocopus ) mehr oder minder ausgeprägt: - eine relativ kurze Spieß-Fangzunge mit vielborstiger, widerhakiger Hornspitze ('Harpune'), - eine relativ kurzen, breiten Hack-Meißel-Schnabel, am relativ breiten, kurzen, verstärkten Schädel, - weit abstellbare Kletterbeine mit nach der Seite spreizbarem Fuß (abspreizbare Außenzehe) und stark gekrümmten Krallen und - einen starken Stützschwanz mit stark versteiften Schwanzfedern.
3. In der Evolution war die Entwicklung einer weit vorstreckbaren Zunge an die Verlängerung der Vorstreck-Muskeln (durch Verlängerung der Zungenbeinhörner um den Schädel herum und mit einer 'Halsschlinge') und der Rückzieh-Muskeln (durch Umwickeln der Trachea) gebunden. In der Evolution der Spechte dürften sich die grundlegenden Anpassungen in mehreren entscheidenden Schritten entwickelt haben, so: - ein ectropodactyler Hänge-Kletterfuß (aus einem zygodaktylen Klammerfuß) und ein Stützschwanz, - eine Fangzunge als Beutegreiforgan, und - ein Hack-Meißel-Schnabel, in Verbindung mit verbessertem Stützschwanz-Klettern. Dabei haben sich die Wendehälse Jynginae (ohne Stützschwanz, ohne Meißelschnabel) wahrscheinlich aus einer kletternden Form mit Stützschwanz, aber ohne Meißelschnabel entwickelt, worauf Merkmale von Fuß (zygodaktyler Klammerfuß), Schwanz (verbreitertes, "spechtartiges" Pygostyl) und Zunge (einfach gebauter Rückziehmuskel) hinweisen.


Abb.7 Wendehals Jynx torquilla beim "Züngeln": Erkunden der nächsten Umgebung nach Beute mit der vorgeschnellten Zunge. Zahmer, vom Menschen aufgezogener Vogel. Längenabschätzung der nahezu maximal vorgestreckten Zunge: ca. 39 mm, knapp so lang wie Kopf mit Schnabel; aus Vergleich mit Körpergesamtlänge 16 - 17 cm, Schädelgröße ca. 43 mm (nach Leiber 1907). Nach Foto in Winkel 1992.
Abb.8 Anatomische Grundlagen der großen Länge und weiten Vorstreckbarkeit der Zunge bei 'Erdspechten': Verlängerung des Zungenskeletts und seiner Muskeln, im Bogen an der Halsseite hinab (Bildung einer 'Halsschlinge') und um den Schädel herum bis ins Innere des Oberschnabels reichend. a) Wendehals Jynx torquilla, b) Grünspecht Picus viridis. 1 verhornte Zungenspitze, 2 'Halsschlinge' der Zungenbeinhörner (Kerato- und Epibranchiale; vorderer Abschnitt des paarigen Teils des Zungenskeletts), 2' ungefähre Lage der 'Halsschlinge' (gestrichelt) beim Wendehals bei völlig zurückgezogener Zunge, 3 Haupt-Vorziehmuskel der Zunge Musc. geniohyoideus (M. branchiomandibularis), mit den Zungenbeinhörnern abstandsfest verbunden, 4 hinterer Abschnitt des Zungenskeletts, mit dem Ende der Zungenbeinhörner in den Oberschnabel reichend, 5 Haupt-Rückziehmuskel der Zunge Musc. tracheohyoideus (M. ceratotrachealis) (bei a) nicht sichtbar), 6 Speicheldrüsen (Glandulae sublinguales) mit klebrigem Schleim, bis zum Hinterkopf reichend, 7 Luftröhre (Trachea), 8 Speiseröhre (Oesophagus). Maßstab: Linie = 1 cm. Abgebalgter Kopf, Oberschnabel aufgebrochen gezeichnet, um das Ende der Zungenbeinhörner zu zeigen. Verändert nach Leiber 1907a, b.


Abb.9 Anatomie der Zunge bei 'Erdspechten': herausgenommene Zunge, vom Schädel abgelöst und in eine Ebene gelegt. a) Wendehals Jynx torquilla, b) Grünspecht Picus viridis. 1 verhornte Zungenspitze, 2 handschuhfingerartig ausgestülpter Zungenkörper ('Zungenschlauch', unpaarer vorderer Teil der Zunge), 3 Zungengrund mit Kehlkopf (Larynx, mit Kehlspalt), 4 Zungenbeinhörner (paariger hinterer Teil der Zunge). Maßstab: Linie = 2 cm. Verändert nach Papadopol 1973.
Abb.10 Anatomie der verhornten Zungenspitze bei 'Erdspechten': a) Wendehals Jynx torquilla, mit glatter Oberfläche; b) Grünspecht Picus viridis, mit wenigborstiger Oberfläche. 1 Spitze mit Hornepithel, Schichten parallel zur Zungen-Längsachse verlaufend ( a ) bzw. dachziegelartig schräg dazu abstehend ( b ), 2 Skelettelement der Zungenspitze (Zungenkern Os entoglossum), 3 Zungenbeinkörper (Skelettstab des Zungenkörpers). Maßstab: Strich = 2 mm. Verändert und kombiniert nach Leiber 1907, Blume 1981.

Abb.11 Lageveränderungen des Zungenskeletts beim Vorstrecken der langen Zunge von 'Erdspechten', am Beispiel des Grünspechtes Picus viridis: Anheben und Verflachen der 'Halsschlinge' und Herausgleiten der Zungenbeinhörner aus dem Oberschnabel-Inneren. a) Ruhestellung, b) größtmögliches Vorstrecken. Zungenskelett-Elemente (dick ausgezogen): 1 Zungenkern (Os entoglossum), 2 Zungenbeinkörper, 3 vorderes Glied des Zungenbeinhorns (Keratobranchiale), 4 hinteres Glied (Epibranchiale). Gestrichelt = Umriß der Hornscheide des Schnabels, Maßstab: Linie = 2 cm. Leicht verändert nach Leiber 1907 (Abbildung leicht verändert gegenüber publizierter Version).
1. Der Wiedehopf (Upupa epops) zeigt bei der Nahrungsaufnahme eine besondere Verhaltensweise: das "Hochwerfen" von Beute. Mit der Schnabelspitze ergriffene Beute wird ruckartig hoch- und zurückgeschleudert, näher am Schnabelgrund wieder aufgefangen und dann verschluckt. Dieses seit langem bekannte Verhalten wird hier photographisch dokumentiert (Abb.2 - Abb.11), mit Schmetterlingsraupen (Eulenfalter Autographa gamma, Noctuidae) und Käferlarven ("Drahtwürmer", Elateridae) als Beute. Größere und auch weiche Beute, wie Schmetterlingsraupen, können zuvor bearbeitet, d.h. ausgequetscht und hin- und hergeschoben werden (Abb.2, Abb.7a, Abb.11b-11g). Der Schnabel ist unmittelbar vor dem "Hochwerfen" meist abgesenkt (Abb.2, Abb.11i). Zum "Hochwerfen" der Beute wird der Schnabel ruckartig hochgenommen (Abb.11h-11j). Während sich die Beute frei fliegend dem Schnabelgrund nähert, bleibt der Schnabel leicht angehoben (Abb.3, Abb.4, Abb.11j), wobei der Hals eingezogen (Abb.3, Abb.4) oder gestreckt sein kann (Abb.2, Abb.11j, 11k). In dieser Position wird die Beute auch wieder aufgefangen und verschluckt (Abb.5, Abb.11k). Während des Verschluckens sind die Federn an Kinn und Kehle bzw. Wangen und Ohr meist leicht abgespreizt (Abb.5). Die kurze Zunge bleibt während des gesamten Ablaufs unsichtbar. - Im Unterschied dazu bearbeitet und verschluckt der Weidensperling (Passer hispaniolensis) den selben Beutetyp (hier: eine Eulenfalter-Raupe) unter fortlaufender Beteiligung der Zunge (Abb.14, Abb.15).
2. Das Verhalten des Wiedehopfes bei der Beutebehandlung scheint kaum jemals genauer untersucht worden zu sein und ist daher lediglich aus Einzelbeobachtungen bekannt. Genauere Beschreibungen des "Beute-Hochwerfens" gehen wahrscheinlich bereits auf Bechstein (1795) und Naumann (1826) zurück und wurden von da offenbar auch in neuere Zusammenfassungen übernommen (oft ohne Quellenangabe; vgl. Anhang 1). - Erstaunlich ist die Schnelligkeit, mit der das "Beute-Hochwerfen" ablaufen kann (oft weniger als 1 s; vgl. Abb.11h-11k). Dies mag dazu beigetragen haben, dass dieses Verhalten eher unbeachtet blieb. Beim "Hochwerfen" von Beute handelt es sich um einen zumindest zweidimensionalen 'Schiefen Wurf' auf den Vogel zu, mit Impuls-Komponenten in senkrechter (nach oben) und waagerechter Richtung (auf den Vogel zu). - Das "Beute-Hochwerfen" wird damit erklärt, dass Wiedehopfe nur eine äußerst kurze Zunge besitzen, welche nicht dabei behilflich sein kann, die Beute von der Spitze zum Grund des Schnabels zu verschieben. Die kurze Wiedehopf-Zunge besitzt ein vollständiges Zungenskelett und dürfte beim Schlucken der Beute ("Hinunterschieben") und Freihalten des Atemweges beteiligt sein (vgl. Anhang 2). - Im Vergleich dazu setzen Sperlinge (Passer) die Zunge bei der Bearbeitung von tierischer Beute offenbar ähnlich ein wie beim Enthülsen von Samen, wobei Ober- und Unterschnabel gegeneinander arbeiten und die Zunge die Nahrung verschiebt (Abb.15).
3. Der feste, massive und seitlich zusammengedrückte Wiedehopf-Schnabel ist zur Schnabelspitze hin besonders verstärkt und weist eine breite Basis am Stirnschädel auf (s. Anhang 3). Dies dürften Anpassungen an das Stochern und Zirkeln auch in härteren Substraten sein. In einem auf diese Weise mechanisch verstärkten, biegefesten Schnabel kann kein Hohlraum für eine lange, große Zunge ausgebildet werden. - Im Unterschied dazu weisen Baumhopfe (Phoeniculidae), die in weicheren Substraten stochern, eine weniger verstärkte Schnabelbasis auf; und Tukane (Ramphastidae), die mit ihrem Schnabel Früchte von Bäumen pflücken, besitzen einen extrem leicht gebauten Schnabel und eine gut ausgebildete, sehr lange Zunge. - Auch der übrige Schnabel-Apparat des Wiedehopfes weist Besonderheiten auf. So sind Ober- und Unterschnabel sowohl gemeinsam als auch getrennt voneinander bewegbar, und die Kiefer-Muskulatur ist verstärkt. Dadurch wird eine größere Beweglichkeit der Schnabel-Hälften ermöglicht und so das Stochern bzw. Zirkeln erleichtert, ebenso wie möglicherweise das "Hochwerfen von Beute". - Bei der Nahrungssuche läuft (Abb.9a) bzw. trippelt der Wiedehopf (und hüpft aber nicht). Das Stochern im Boden, zumeist aus relativ kurzen Stoßphasen (mittlere Dauer von 1,2 s ), erfolgt mit zunächst geschlossenem oder spaltförmig geöffnetem Schnabel (Abb.9b, 9c, 9d). Die Beute wird mit der Schnabelspitze ergriffen, nachdem sie optisch, taktil oder akustisch wahrgenommen wurde. Das Stochern ist offenbar angeboren. Größere Beutetiere werden vor dem "Hochwerfen" bearbeitet, z.B. um abstehende oder harte Teile (Flügel, Beine von Insekten) zu entfernen, um die Beute zu töten oder um Inhaltsstoffe auszupressen (vgl. Abb.7a, Abb.11a-11g).
4. Das "Hochwerfen von Nahrung", aus der Schnabelspitze in den Schlund, ist auch von anderen langschnäbeligen Formen in der engeren und weiteren Verwandtschaft der Hopfvögel (Upupae) bekannt, so von Hornvögeln (Bucerotidae) und Tukanen (Ramphastidae; s. Anhang 4). - Unter Berücksichtigung der Verwandtschaftsverhältnisse ergeben sich zwei alternative Hypothesen für die Entstehung dieser Verhaltensweise in der Stammesgeschichte. - Zum einen könnte das "Hochwerfen von Nahrung" bereits bei der gemeinsamen Stammart der Hopfvögel (Upupae: Upupidae + Phoeniculidae + Bucerotidae) vorhanden gewesen sein und wäre so ein gemeinsames abgeleitetes Merkmal (Synapomorphie) der Upupae. Dann wäre dieses Merkmal bei den Phoeniculidae wieder verloren gegangen und bei den Ramphastidae (innerhalb der Spechtvögel Pici) parallel entstanden. - Zum anderen könnte das "Hochwerfen" bereits früher bei der gemeinsamen Stammart von Hopf- (Upupae) und Spechtvögeln (Pici) entstanden sein und dann als ursprüngliches Merkmal (Symplesiomorphie) nur bei einem Teil der Upupae und bei Tukanen (Ramphastidae) erhalten geblieben sein. In der weiteren Verwandtschaft der Hopf- und Spechtvögel fehlt eine vergleichbare Verhaltensweise wie das "Hochwerfen von Beute" offenbar, so auch bei langschnäbeligen und kurzzüngigen Formen der Rackenvögel (Coracii) und Eisvögel (Alcedini). - Eine Entscheidung zugunsten einer der Hypothesen erscheint aber erst sinnvoll mit genaueren Kenntnissen über das Vorkommen des "Hochwerfens von Nahrung" und über die Schluckbewegungen bei den Upupae, Pici, Coracii und Alcedini und unter Zuhilfenahme von weiteren morphologischen und ethologischen Merkmalen in diesen Gruppen. - Ein Vergleich mit den "Rüttelbewegungen" von langschnäbeligen Watvögeln (Limicolae) bei der Nahrungssuche zeigt, dass beim "Hochwerfen" der Hopfvögel sich die Beute losgelöst im eher weit geöffneten Schnabel bewegt, während bei den "Rüttelbewegungen" der Watvögel die eher festgeklemmte Beute durch "Nachfassen" im nur wenig geöffneten Schnabel zum Schlund hin verschoben wird. Dabei sind die "Rüttel-Schleuderbewegungen" von ebenfalls kurzzüngigen Brachvögeln (Numenius) bei der Aufnahme großer Beutetiere und die "Abschluckwurfbewegungen" von langschnäbeligen, kurzzüngigen Schreitvögeln (Ciconiae) dem "Hochwerfen" der Wiedehopfe am ähnlichsten.
5. Zusammenfassend lässt sich folgern, dass auch zwei Jahrhunderte nach den ersten genaueren Schilderungen aus der "Vor-Fernglaszeit" selbst grundlegende Fragen zu Nahrungssuche und Beutebearbeitung beim Wiedehopf weiterer Klärung bedürfen. Eingehendere Kenntnisse darüber dürften auch für wirksamen Naturschutz bedeutsam sein.

E.1 Register - Stichwort-Verzeichnis (in Deutsch) zu: Ökologie der Vögel 16 (1), 1994: 1-581.
Martin Schön: Verhaltensbiologie und Lebensraum des Raubwürgers (Lanius excubitor).
Verhaltensökologische Aspekte von Paarbildung, Brut- und Populationsbiologie, von Gefieder-Zeichnung
und Habitatwahl im Gebiet der Südwestlichen Schwäbischen Alb.
Ökol. Vögel 16 (1), 1994: 1-581.
Register - Stichwort-Verzeichnis
Zahl = Seitenzahl, fett = Abbildung, kursiv = Tabelle, D allgemeine Darstellung, n Einzelnachweise (für Auswertungen, Artenlisten, Zitate), P gesamte Publikation (in Ökol. Vögel 16 (1) ), V Arten-Vergleich
Abstände der Gehölze 298-307, 300-304, n 434-435 Aktionsraum, s. Reviergröße Alter Höchst- 230, V 238 Altersmerkmale 36-37, 37, 47, Vn 68-69 Altersstadien - Hecken 572-573, 573 Altersverteilung Population 225-227, 227 Anpaarung Herbst 104, Vn 137 Anzeiger-Art (Indikator) 572 Arten-Liste Würger Laniidae 60-61, 552 Astkorb Nest 509-510, 508 Augenstellung 4-6, 2, 3 Ausapern 389-394, 390-394, 397, 398, n 456-458, im Wald 397-398, 397, 398, n 457, n 458 Außennest 509, 509, V 522-523, Vn 542-543, Vn 545, n 551 Außerpaar-Junge (extra-pair young) 112 Außerpaar-Kontakte, s. Besuche 109-113, Vn 144-145 Außerpaar-Kopulationen DV 111-113 Aussterben 416, 420-421, 514-515
Balzfütterung 95, 107, 109-110, 96 Balzspeichern 84, 95, D 108 Balz-Verhalten 100-102, DV 108-109, 101, Vn 144 Bauch-Zuwenden 371, s. Sichtkontakt Begleitarten P 567-581, 580, 571-572, V 576-577 Besetzungsdauer Reviere 303-305, 305, 320 Bestand 224, 225 Bestandsrückgang 224, V 236, 225, D 416-420, 514-515 Bestandsschwankung DV 235-236 Bestandszunahme/-abnahme 236, 416 Besuche 109-113, DV 111-113, 110, Vn 144-145 Beute Erreichbarkeit 395, V 398-399 Beweidung 388-389, V 395-396, n 454-457 Bewirtschaftung 400-410 traditionelle 401-403, 404-410 Boden-Bedeckung DV 378 Brut-Aufteilung 121, 124, D 125-126, Vn 148, Vn 149-152 Brutausdauer 190-191, D 201-202 Brutbiologie P 173-217 Bruterfolg 187-191, 188, 189, D 191-202, V 192, V 193, V 194-197 - Bestand 417, V 462 - Nestschutz V 523, n 547 - Wiederbenutzung Nester 526, V 529, Vn 549, Vn 551 Brutgröße (juv.-Zahl) 178, 178, D 184, V 185-187 Brut-Verhalten P 81-172 Brutverluste D 198-200, 190 Brut/Winter-Unterschiede im Habitat D 339-342, Vn 446-449 - Abstände 301-304, 302-304 - Wartendichte 309-311, 310, 311 - Holzgewächs-Typen 318-319, 319, 320, 323-324, 324 Brutzeit 115-119, 114, V 117-118, Vn 146 Brutzyklus 114-115, D 115-120, 114 Bulte 388-389, 390-392, n 454-455, n 458
Dominanz von Greifen, Krähenvögeln D 414-415 Dominanz-Verhalten in Paaren 91-94, 93, 94, D 106-107 Dominanz-Wechsel V 106-107, Vn 140-141
Eiablage 114-115, 114, 115 ekto-/endotherme Beute 395, V 411-412, n 457 Ersatzbruten 178, 190-191, 201-202 Evolution - Geschlechtsmerkmale Flügel 48-50, 69-70 - Habitatwahl V 377, DV 410-415 - Paarbindung 132-135 - Revier-Verhalten DV 375-376 - Schnabelfärbung 48 - Subspezies-Gruppen von L.[excubitor] 410-413, 420-421, Vn 442-446 - Nesthöhen 521 Exposition DV 378-379 Extensiv-Bewirtschaftung 401-408, 404-410
Familien-Auflösung 121-125, D 127-130, V 129-130, 123 Feinde 414-415, 420, n 462 Feuchtstellen 385-386, n 453 Flächen, s. Grundflächen der Gehölze Flügel-Zeichnung, s. Geschlechtsmerkmale, s. Zeichnungsmuster Fremdkopulationen, s. Außerpaar-Kopulationen Fressplätze, s. Hauptaufenthaltsplätze Füße 4-8, 7
Gehölze im Lebensraum - Hauptarten DV 379-380 - Struktur 298-342 Gelegegröße 178, 178, D 178-183 - Erst-, - Ersatz- V 204, 205 - jahreszeitlich V 203 Geschlechtsmerkmale Flügel - L. excubitor 17-20, 18, 19, 20, 38 - Einzelfeder 21-24, 22-23, 33 - Trennschärfe 25-32, 26, 29, 30 - L. ludovicianus 40-43, 41, 42 - Laniidae 39-46, 45-46, n 64-66 Geschlechtsmerkmale Schwanz 33-34, 33, 34, 44 Geschlechtsverteilung - Jungvögel 121, V 126 - Population 225-227, 226 Greifvögel Nest-Wiederbenutzung Vn 551-552 Greifvogel-Eigenschaften P 1-10, D 2-8 Grundflächen der Gehölze 312-316, 314, DV 315-316, D 435 Gruppen-Bildung Reviere 227-230, V 238-239, 229, Vn 240-243 Gruppen-Treffen 91, V 104-106, 90, Vn 138, Vn 139
Habitat, s. auch Lebensraum P 253-495 - Flächen-Anteil 283-284, 284 Habitat-Aufbau, s. auch Lebensraum D 376-380, Vn 442-446 Habitat-Fotos 271-274, n 377 Habitat-Karten 276 Habitat-Nutzung jahreszeitlich 281-282, 280-281, n 432 Habitat räumlicher Aufbau 356-366, Vn 437-439, 358-363, 364 Habitat-Schema 427-431, 428, 430 Habitat-Typen 270, 317, 377, 380-385, 382, Vn 451-452 Habitat-Unterschiede 333-339, 334-336, 338 Habitat-Veränderungen 343-355, 344-346, 348-353, 404-410 Habitatwahl D 410-415 Habitat-Wechsel, s. Brut/Winter-Unterschiede DV 382-383, 382 Hauptaufenthaltsplätze 325-331, 327, DV 328-330, 363-364, 363 Hecken-Heide-Habitat 270, 273, 274, 317, 322-323, 323, 333-339, 334-336, 404, 406, 430 Historische Veränderungen 512, n 536-537, n 539 Hochflüge, s. Sichtkontakt-Verhalten 366-372, 367, 369, 370, Vn 440-441 Höchstalter, s. Alter Höhe der Gehölze 315, 378, V 450-451 Holzgewächs-Typen 317-324, 323 Horst-Pflanzen 388, 396, 388, 391, 392, n 458-459
Individualabstand 373 Individuelle Merkmale 56-60, 57, 58, 59, n 72-73 Innen-Nest 526
Jahreszeit, s. Brut/Winter-Unterschiede Jungvögel Selbständigkeit, s. Selbständigkeit
Kleinstrukturen 387-400, 388, 390, 391-394, 397, 398, 400, n 458-459 Kleinstrukturen Abtauen, s. Ausapern 389-399 Klima, s. Witterung 133, D 198-200, 294, 296 Körpergröße (-Masse) DV 294, V 295 Kontrast-Verstärkung, s. Signale 51-56, 54, Vn 70-71 Kopulationen 97, V 112-113, 96, 97 Kulturfolger/-flüchter DV 384-385, n 452 Kulturgeschichte D 402-403, 404-410, n 460-461 Kultur-Landschaften traditionelle 380-382, 400-410, 382, 404-410, Vn 460, n 463-466
Laniidae Arten 45-46 Lanius-Arten 46 Landschafts-Aufbau, s. Habitat-Aufbau, räumlicher Aufbau Landschaftspflege 421-425, 423 Landschafts-Veränderungen D 346-355, 348, 350, 352-353, Vn 436-437, n 459-460 Lebensraum, s. Habitat P 253-495 Leitart 572 Luftbilder 276, n 432, 348, 350, 404, 406, 408, 410
Mauser 24, 36, 47, - Verhalten 328 Mauserplätze 325-331, DV 331, 363-364, 327, 363, 364 Methode - Abstände 299-300, 305-306, 300, 306 - Grundflächen 312-314, 313, n 435 - Wartendichte 308, 311, n 432, 434 Mitwelt, s. Begleitarten Monogamie D 134-135
Nahrungsaufteilung in Paaren 94-97, D 107, 96, 97, Vn 142-143 Nahrungsreichtum n 461-462 Nahrungsspektrum D 296-297 Nahrungsverknappung 399, 417-419 Naturschutz D 420-427, 423 Nest P 497-566 Nest - Astkorb 509-510, 508 Nest-Aufbau DV 526 Nestbau Jahreszeit 99, 98, 114, n 145-146 Nestbau-Verhalten DV 547-548 Nest-Exposition V 519 Nestfeinde Suchbild D 524, 547 Nest - Gehölzarten n 536-537, n 538 Nest - Gehölztypen 503-504, 504, DV 512-515, 514, Vn 536-538 Nesthäkchen 122, D 126 Nest - Haltbarkeit 526, Vn 549-551 Nesthelfer 113 Nest-Höhe 504, 506, 515-519, V 516-518, Vn 538-540 Nestplatz P 497-566 Nestplatz - Feinstruktur 502, 507-509, 508, 509, D 522-523, 523, Vn 542, Vn 544 Nestplatz-Mangel V 529 Nestplatz - Lage in Landschaft 363, 363, 364, Vn 424-425 Nestplatz - relative Lage im Gehölz 504-505, 506, V 519-521, 524, n 540-541 Nestplatztreue 527, D 529 Nestplatz-Wahl V 108 Nestplatz-Wechsel 524-525 Nest-Schutz DV 522-524, Vn 541-545, Vn 547 Nest - Umgebung 502, 509-512, 511 Nest-Wiederbenutzung 525-530, V 528, Vn 548-552 Nestzeige-Verhalten 97-100, D 108, 98, 99, 100, Vn 143 Nord-/Süd-Gruppe von L. [excubitor], s. Evolution Subspezies-Gruppen D 410-415, D 521 Nutzung jahreszeitlich, s. Habitat-Nutzung
Ortsnähe 345, 346, V 355, n 437 Ortstreue 124-125, 134, 230, V 237-238, n 239
Paar-Auflösung 123-125, n 155 Paar-Bildung, -Zusammenhalt 89, V 103-104, 90, Vn 136-137, n 155 Paarbindung P 81-172, 102-104, 123, D 132-135, n 155 Partner-Begleiten (mate-guarding) V 113 Pflanzen-Gesellschaften 275, 573 Phylogenie, s. Stammesgeschichte Populationsbiologie P 219-252
Rand Innen-, Außen- n 434-435 Rassen, s. Subspezies Revier-Anzeigen DV 373-376 - Rufe 374 Reviere - Anzahlen 283-285, 285 Reviere - Besetzungsdauer 303-305, 305 Reviergröße 281, 285, 287-288, DV 289-297, 433, 286, V 291-293, V 295-296 Reviere historisch 347 Reviere räumlicher Aufbau 356-366, 358-363, Vn 437-439 Reviertreue Vn 239, Vn 244 Reviere - Wert 427, n 463 Ringfunde 230 Rückgang, s. Bestandsrückgang
Saisonehigkeit DV 132-135 Schlafplätze 325-331, DV 329-331, 363-364, 363 - Gruppen- 106 Schnabel äußerer Bau 2-5, 4, 5 Schnabelumfärbung 34-36, 35, Vn 69 Schwanz, s. Geschlechtsmerkmale Sehvermögen V 373-374, Vn 439 Selbständigkeit Jungvögel 120, D 127-130, Vn 146-147, V 129-130 Sichtkontakt-Punkte - Nest 511-512, 511 Sichtkontakt-Sitzen 366-372, 367, 369, 370, Vn 439-440 Sichtkontakt-Verhalten 366-376, 367, 369, 370, DV 373-376, Vn 439-441 Sichtverbindung 363, 358-362 Siedlungsdichte 224, V 231-236, 225, 232-234 Siedlungsnähe, s. Ortsnähe Signale optische, s. Zeichnungsmuster, s. Geschlechtsmerkmale D 51-56, 52, 54, n 70-72 Sitzen, s. Sichtkontakt-Sitzen Sozialverhalten, s. Brut-Verhalten - Paarbildung 89-91, 90 - Stand-/Zugvögel V 55, Vn 71 Soziobiologie, s. Besuche - Begriffe Deutsch 87 - Paarbindung 111-113, 134 Stammesgeschichte - Paarbindung 135 - Zeichnungsmuster 48-50 Standvogel 105, 119, D 130-131 Standvogel - Subspezies n 71, 237-238 Statistik 276-277, 436, n 432 Steinriegel-Hecken-Landschaft 392, 393, 404, 406 - Pflege 422-424, 423 - Sukzession 393, 402, 406, 573 Störungen 345-347, 419-420, 426-427, 436, 346, Vn 437 Streuobst-Habitat (-Landschaft) 270, 317, 322-323, 333-339, 574-575, 271, 272, 323, 334-336, 348, 394, 408, 410, 428, 575, n 459, n 462-463 Struktur-Merkmale 298-342 Subspezies-Gruppen von L. excubitor - Habitate D 377, DV 410-413 - Nester D 521 - Siedlungsdichte 234, 232 Sukzession von Hecken 573 Synchronisation Bruten 102-105, DV 119-120
Tarnung - Nester 522, Vn 545-547, - Gefieder-Zeichnung 55, Vn 70-71 Traditionen Reviere 229-230, V 239, Vn 244 Trennschärfe der Geschlechtsmerkmale - L. excubitor 25-32, 26, 29-30, 33-34, 34 - L. ludovicianus 39, 41-42, 44
Übersichtlichkeit DV 364-366, D 375-376, D 414-415 Unerreichbarkeit Nest V 523-524, Vn 541-545 Untersuchungsgebiet/-zeitraum 223-225, 270-275, 225, 270
Verwilderungen Nestplätze 424-425, n 462-463, V 522 Volksglaube Vn 459
Wacholderheide, s. Hecken-Heide-Habitat 350, 388, 390, 391, 404 Wald-Anteil 315, 385, 382 Waldgrenz-Standorte 377 Wald-Habitate Vn 452-453 Wald-Landschaften Ausapern 397-398, 397, 398 Wartendichte 308-312, DV 311-312, 435-436, 309-311 Warten-Höhe 315, 378, Vn 450-451 Warten künstliche 386-387, Vn 453-454 Warten-Modell 421-422, 421 Weidepfade 399-400, 400 Wiederbenutzung von Nestern/ Nestplätzen, s. Nest-Wiederbenutzung Witterung Brut-Verluste 115-116, D 198-200 Wuchsdichte 395, V 399, 418-419 Würger Flügelzeichnung 40, 45-46, Vn 66-68
Zeichnungsmuster P 11-80 - Finken, Greifvögel, Möwen, Watvögel D 55, n 71 - Würger Vn 66-68 Zugverhalten DV 237 Zugvogel 105, D 119, D 130-131 - Subspezies n 71 Zweitbruten Vn 205-206
E.2 Index (in English) for: Ökologie der Vögel (Ecology of Birds) 16 (1), 1994: 1-581.
Martin Schön: Eco-ethology and Habitat of the Great Grey Shrike (Lanius excubitor).
On Plumage Pattern, and on Pair-Bond, Breeding Biology, Population Biology,
and Habitat Selection in the Region of the Southwestern Schwäbische Alb.
Ökol. Vögel 16 (1), 1994: 1-581.
Index
number = page, number in bold type = figure, with text in English, number in italic type = table, with text in English, C comparison of species, D general discussion, n detailed records (for quantitative comparisons, for lists of species, of quotations), P entire publication (in Ökol. Vögel 16(1) ), S Summary in English
aerial photos 276, n 432, 348, 350, 404, 406, 408, 410 age characteristics 36-37, 37, 47, Cn 68-69, S 12 age: maximum 230, C 238 age ratio in population 225-227, 227, S 219 age stages (states of ageing) of open hedges 572-573, 573, S 567 areas, see basal-areas
basal-areas of woody plants 312-316, 314, DC 315-316, D 435, S 255 bill structure 2-5, 4, 5, S 1 bill colour changes 34-36, 35, Cn 69, S 12 body size DC 294, C 295, S 254 breeding behaviour P 81-172 breeding biology P 173-217 breeding cycle 114-115, D 115-120, 114, S 81-82 breeding persistance 190-191, D 201-202, S 174 breeding season 115-119, 114, C 117-118, Cn 146, S 82 breeding success 187-191, 188, 189, D 191-202, C 192, C 193, V 194-197, S 174 brood-division 121, 124, D 125-126, Cn 148, Cn 149-152, S 83 brood losses D 198-200, 190, S 174 brood size 178, 178, D 184, C 185, 187, S 173
camouflage - nests 522, Cn 545-547, S 498 - plumage pattern 55, Cn 70-71 climate 133, D 198-200, 294, 296, S 83 clumping, see groups of territories clutch size 178, 178, D 178-183, S 173 - first, second C 204, 205 - seasonal C 203 community of species P 567-581, 580, 571-572, V 576-577, S 567 conservation measures 421-425, 423, S 260 contrast of optical signals 51-56, 54, Cn 70-71, S 12 copulations 97, C 112-113, 96, 97 courtship behaviour 100-102, DC 108-109, 101, Cn 144, S 82 courtship feeding 95, 107, 109-110, 96, S 82 courtship storing 95, D 108, S 82 cultivation: traditional 401-403, 404-410, S 259 cultural history D 402-403, 404-410, n 460-461, S 259 cultural landscapes: traditional 380-382, 400-410, 382, 404-410, Cn 460, n 463-466, S 259
decline 224, C 236, 225, D 416-420, 514-515, S 219 density: breeding/winter 224, C 231-236, 225, 232-234, S 219-220 density - fluctuations DC 235-236, S 219-220 density - increase/decrease 236, 416 dissolution of families 121-125, D 127-130, C 129-130, 123, S 82-83 dissolution of pairs 123-125, n 155, S 82 distances of woody plants 298-307, 300-304, n 434-435, S 254 disturbances 345-347, 419-420, 426-427, 436, 346, Cn 437, S 260 dominance relationships in pairs 91-94, 93, 94, DC 106-107, Cn 140-141, S 81
ecto-/endothermic prey 395, C 411-412, n 457, S 259 edge (ecotone) inside/outside n 434-435 egg-laying 114-115, 114, 115, S 82 evolution - of bill colour 48 - of habitat selection C 377, DC 410-415, S 259 - of pair-bond 132-135, S 83 - of sex characteristics on wings 48-50, 69-70, S 12 - of subspecies (two groups) of L. [excubitor] 410-413, 420-421, Cn 442-446, S 259 - of territory advertisement DC 375-376, S 257-258 extinction - process 416, 420-421, 514-515, S 229 extra-pair contacts, see visits 109-113, Cn 144-145, S 82 extra-pair copulations DC 111-113, S 82 extra-pair young 112, S 82 eyes: position 4-6, 2, 3, S 1
feeding sites, see main sites feet 4-8, 7, S 1 fluctuations, see density food sharing in pairs 94-97, D 107, 96, 97, Vn 142-143, S 82 food shortage 399, 417-419, S 259 forested parts of habitat 315, 385, 382, S 255, S 258
grazing 388-389, C 395-396, n 454-457, S 258 - tracks 399-400, 400, S 258 groups of territories 227-230, C 238-239, 229, Cn 240-243, S 220 group-meetings 91, C 104-106, 90, Cn 138, Cn 139, S 81
habitat P 253-495 - breeding/winter differences D 339-342, Cn 446-449, S 255 - distances 301-304, 302-304 - perch-density 309-311, 310, 311 - types of woody plants 318-319, 319, 320, 323-324, 324 - habitat: changes of habitats 343-355, 344-346, 348-353, 404-410, S 256-257 - differences between two types of habitats 333-339, 334-336, 338, S 256 - habitat - forested parts 315, 385, 382, S 255, S 258 - habitat - historical changes 512, n 536-537, n 539, S 498 - model of habitat 427-431, 428, 430 - habitat - photos 271-274, n 377 - habitat - proportion 283-284, 284, S 254 - habitat - seasonal change, see breeding/winter differences DC 382-383, 382, S 258 - habitat - seasonal utilization 281-282, 280-281, n 432, S 254 - habitat - spatial structure 356-366, Cn 437-439, 358-363, 364, S 257 - habitat - structure in different landscapes D 376-380, Cn 442-446, S 258 - types of habitat 270, 317, 377, 380-385, 382, Cn 451-452, S 256 habitat selection D 410-415, S 259 habitat with heath 350, 388, 390, 391, 404 habitat with hedges and heath 270, 273, 274, 317, 322-323, 323, 333-339, 334-336, 392, 393, 404, 406, 430, S 255-256 - conservation 422-424, 423, S 260 - succession 393, 402, 406, 573 habitat with traditional orchards 270, 317, 322-323, 333-339, 574-575, 271, 272, 323, 334-336, 348, 394, 408, 410, 428, 575, n 459, n 462-463, S 255-256 heath, see habitat with heath hedges, see habitat with hedges height of woody plants 315, 378, C 450-451, S 256 helpers-at-the-nest 113
inaccessibility nest C 523-524, Cn 541-545, S 498 increase, see density independence of young 120, D 127-130, Cn 146-147, C 129-130, S 83 indicator 572, S 567 individual characteristics 56-60, 57, 58, 59, n 72-73, S 12
landscapes, see habitats with ... - changes in the structure D 346-355, 348, 350, 352-353, Cn 436-437, n 459-460, S 256-257 Laniidae 45-46 - list of species of shrikes 60-61, 552 Lanius: species 46
main sites (for feeding, for roosting) 325-331, 327, DC 328-330, 363-364, 363, S 256 mate-guarding C 113 micro-structures 387-400, 388, 390, 391-394, 397, 398, 400, n 458-459, S 258-259 - mounds, tussocks 388-389, 390-392, n 454-455, n 458, S 258-259 - snowlessness 389-399 migrants 105, D 119, D 130-131, DC 237, S 82-83, S 220 - subspecies n 71 monogamy D 134-135, S 83 moult 24, 36, 47, - moult - behaviour 328 moulting sites 325-331, DC 331, 363-364, 327, 363, 364, S 256 mounds, see micro-structures
nature conservation D 420-427, 423, S 260 nest P 497-566 nest-building behaviour DC 547-548 nest-building season 99, 98, 114, n 145-146, S 82 nest defence DC 522-524, Cn 541-545, Cn 547, S 498 nest - durability 526, Cn 549-551, S 499 nest-height 504, 506, 515-519, C 516-518, Cn 538-540, S 498 nestling - youngest 122, D 126 nest-site P 497-566 - nest-site - "basket" 509-510, 508, S 498 - nest-site - change 524-525, S 499 - nest-site display 97-100, D 108, 98, 99, 100, Cn 143, S 82 - nest-site fidelity 527, D 529, S 499 - nest-site - micro-structure 502, 507-509, 508, 509, D 522-523, 523, Cn 542, Cn 544, S 498 - nest-site - position in landscape 363, 363, 364, Cn 424-425, S 257 nest-site - relative position 504-505, 506, C 519-521, 524, n 540-541, S 497 nest-site - reuse 525-530, C 528, Cn 548-552, S 499 nest-site selection C 108 - nest-site - species of woody plants n 536-537, n 538, S 498 -nest-site - types of woody plants 503-504, 504, DC 512-515, 514, Cn 536-538, S 498 - nest-site - "wilderness" 424-425, n 462-463, C 522, S 498 nest structure DC 526, S 499 nest surroundings 502, 509-512, 511, S 497 northern/southern group of subspecies of L. [excubitor], see evolution: - subspecies D 410-415, D 521, S 259
occupation period of territories 303-305, 305, 320, S 254 optical signals P 11-80, see sex characteristics D 51-56, 52, 54, n 70-72, S 12 - plumage pattern of finches, gulls, raptors, waders D 55, n 71 - of shrikes Cn 66-68 orchards, see habitat with orchards outer nest 509, 509, C 522-523, Cn 542-543, Cn 545, n 551, S 498
pair-bond P 81-172, 102-104, 123, D 132-135, n 155, S 83 - seasonal DC 132-135 pair-formation 89, C 103-104, 90, Cn 136-137, n 155, S 81-82 perches, see habitat - artificial 386-387, Cn 453-454, S 258 - model - distribution of perches 421-422, 421, S 260 perch-density 308-312, DC 311-312, 435-436, 309-311, S 255 perch-height 315, 378, Cn 450-451 phylogeny - pair-bond 135, S 83 - plumage pattern 48-50, S 12 population biology P 219-252 prey accessibility 395, C 398-399, S 260 proximity to villages / settlements 345, 346, C 355, n 437, S 256-257
raptors - reuse of nests Cn 551-552, S 499 raptor-features P 1-10, D 2-8, S 1 recoveries 230 replacement clutches 178, 190-191, 201-202, S 174 residents 105, 119, D 130-131, S 83 - subspecies n 71, 237-238 roosting sites 325-331, DC 329-331, 363-364, 363, S 256 - groups 106
seasonal change of habitat, see habitat - breeding/winter differences second broods Cn 205-206, S 174 sex characteristics on wing - L. excubitor 17-20, 18, 19, 20, 38, S 11-12 - individual feather 21-24, 22-23, 33 - significance of differences 25-32, 26, 29, 30 - sex charcterisitics - L. ludovicianus 40-43, 41, 42, S 11-12 - significance of differences 39, 41-42, 44 - sex charcteristics - Laniidae 39-46, 45-46, n 64-66 sex characteristics on tail 33-34, 33, 34, 44 - significance of differences 33-34, 34, 44 sex ratio - of juveniles 121, C 126 - in wintering population 225-227, 226, S 219 shrikes Laniidae 45-46 - list of species 60-61, 552 - wing pattern 40, 45-46, Cn 66-68, S 11 site fidelity, see territory 124-125, 134, 230, C 237-238, n 239, Cn 244, S 83 size of woody plants, see basal-areas snowlessness 389-394, 390-394, 397, 398, n 456-458, S 258-259 - wood 397-398, 397, 398, n 457, n 458 social behaviour, see breeding behaviour - pair formation 89-91, 90, S 81 - residents / migrants C 55, Cn 71, S 12 sociobiology, see visits - terms 87 - pair-bond 111-113, 134, S 83 statistics 276-277, 436, n 432 structural characteristics of habitats 298-342, S 254-256 study area 223-225, 270-275, 225, 270 subspecies' groups of L. excubitor - densities 234, 232, S 219 - habitats D 377, DC 410-413, S 259 - nests D 521, S 498 succession of hedges 573 surveyability DC 364-366, D 375-376, D 414-415, S 257, S 259 synchronization of breeding 102-105, DC 119-120, S 82
territory advertisement (territorial behaviour) DC 373-376, S 257-258 - calls 374 territories - economic value 427, n 463 - numbers 283-285, 285 - occupation period 303-305, 305, S 254 - site fidelity Cn 239, Cn 244 - territories - size 281, 285, 287-288, DC 289-297, 433, 286, C 291-293, C 295-296, S 254 - territories - spatial structure 356-366, 358-363, Cn 437-439, S 257 traditions - territories 229-230, C 239, Cn 244, S 220 tussocks, see micro-structures - plants growing in tussocks 388, 396, 388, 391, 392, n 458-459, S 258
umbrella species 572
visits 109-113, DC 111-113, 110, Cn 144-145, S 82 visual connection 363, 358-362, S 257 visual contact behaviour 366-376, 367, 369, 370, DC 373-376, Cn 439-441, S 257 visual faculties C 373-374, Cn 439, S 257 visual high-flights 366-372, 367, 369, 370, Cn 440-441, S 257 visual perching 366-372, 367, 369, 370, Cn 439-440, S 257 - near nest 511-512, 511, S 497
weather, see climate - brood losses 115-116, D 198-200, S 174 wing pattern, see sex characterisitics wooded habitats Cn 452-453, S 258 wooded landscapes - snowlessness 397-398, 397, 398 woody plants: - list of species DC 379-380 - structural characteristics 298-342, S 254-256 - types 317-324, 323
Zeitschrift / Journal:
Ökol. Vögel (Ecol. Birds)
«Ökologie der Vögel» - Verhalten, Konstitution, Umwelt
«Ecology of Birds» - eco-ethology, eco-physiology, eco-morphology
ISSN 0173-0711
Ökologie der Vögel erscheint von 1979 bis 2017 (Bd. 1 - 36). Ecology of Birds published 1979 - 2017 (36 volumes).
Internet-Seite / Website:
erstellt am / first installed on: 28. Juli 2008 / 28 July 2008;
zuletzt geändert am 2. Februar 2024 / last modified on: 2nd February 2024.